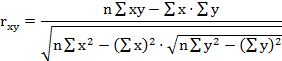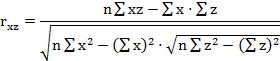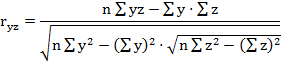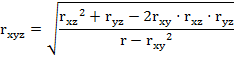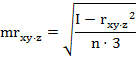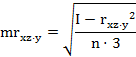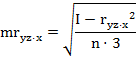МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
|
«УТВЕРЖДАЮ»
Заместитель
Главного
Государственного санитарного
врача СССР
А.И.
ЗАЙЧЕНКО
«14»
апреля 1980 г.
№
2166-80
|
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ИСПОЛЬЗОВАНИЮ ПОВЕДЕНЧЕСКИХ
РЕАКЦИИ ЖИВОТНЫХ В ТОКСИКОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЯХ ДЛЯ ЦЕЛЕЙ
ГИГИЕНИЧЕСКОГО НОРМИРОВАНИЯ
Киев,
1980 г.
В настоящих «Методических рекомендациях» изложены основные
принципы и методические приемы по экспериментальной оценке действия
промышленных ядов на нервную систему.
Методические рекомендации рассчитаны на специалистов
научно-исследовательских учреждений гигиенического профиля (токсикологов и
гигиенистов) системы Минздрава СССР и лабораторий токсикологии отраслевых
институтов.
Авторы: профессор, докт. мед. наук Е.Н. Буркацкая,
ст. и. сотрудник, канд. мед. наук В.Ф. Витер (Киевский НИИ гигиены труда
и профзаболеваний); ст. науч. сотрудник, канд. мед. наук Л.А. Тимофиевская,
ст. науч. сотрудник Е.С. Балынина, мл. науч. сотрудник, канд. биол. наук
К.А. Веселовская (НИИ гигиены труда и профзаболеваний АМН СССР); ст. науч.
сотрудник, канд. мед. наук Л.Ф. Шашкина, мл. науч. сотрудник М.И.
Голубева (филиал ВНИХФИ, Купавна, Московской обл.).
СОДЕРЖАНИЕ
В настоящее время в токсикологии
существует несколько направлений в изучении поведенческих реакций
экспериментальных животных. Из них необходимо выделить 2 направления. Первое -
использование метода условных рефлексов, второе - применение поведенческих
тестов, основанных на изучении ориентировочно-исследовательской реакции.
Методологической основой, способной синтезировать отдельные
реакции поведенческого характера с общефизиологических позиций, является теория
о функциональной системе, нарушение целостности которой приводит к изменению
поведенческого акта.
Метод условных рефлексов вошел в число весьма
распространенных методов исследований, применяемых для оценки токсичности новых
химических веществ с целью экспериментального обоснования гигиенических
нормативов. Наиболее обоснованно применение указанного метода для определения
порога острого действия нейротропных ядов, а также для выяснения механизма
действия на центральную нервную систему с параллельным использованием
нескольких методик. Высокая пластичность высшей нервной деятельности затрудняет
трактовку результатов применения метода условных рефлексов в хроническом
эксперименте, т.к. наблюдаются волнообразные изменения, чередование периодов нарушения
с периодами полного восстановления, несмотря на продолжающуюся затравку.
Вследствие большой трудоемкости классического метода
условных рефлексов для целей токсикологии зачастую используют более простые
методы, например, условный рефлекс пассивного избегания (УРПИ), условный
рефлекс одного сочетания и поведенческие реакции.
Значительное повышение интереса исследователей к
использованию поведенческих реакций объясняется прежде всего доступностью и
высокой чувствительностью методов их изучения. Последнее объясняется
особенностью нейрофизиологического механизма протекания поведенческих реакций,
физиологичностью условий исследования и регистрации поведения. Поведение, как
биологический параметр, может быть количественно измерено, на этом свойстве
основаны методы регистрации поведенческих реакций, которые с успехом
применяются при изучении высшей нервной деятельности в физиологии,
фармакологии, психогенетике. В токсикологии также выделился самостоятельный
раздел - поведенческая токсикология.
Основой проявления любых поведенческих реакций животных
является ориентировочный рефлекс (О.Р.). Понятие об О.Р. разработано школой
И.П. Павлова.
Одной из основных характеристик О.Р. следует признать то,
что он является установочной реакцией, отражающей деятельность целого
организма. Поэтому поведенческие реакции следует рассматривать, прежде всего, в
качестве интегральных показателей состояния организма, а при выраженном
нейротоксическом действии в качестве чувствительных специфических тестов.
О.Р. возникает как безусловный рефлекс, протекает как
условный и проявляется при действии нового, необычного раздражителя, независимо
от его качества (1-я фаза - реакция на новизну), в виде двигательной реакций,
направленной на обеспечение наилучшего восприятия раздражителя (2-я фаза -но
Павлову, рефлекс «что такое?»). Основой его являются двигательно-установочные
рефлексу, двигательная активность. Ввиду сложного состава О.Р. предлагается
термин ориентировочная реакция (по Д.А. Бирюкову), в литературе также
встречается термин ориентировочно-исследовательская реакция или
исследовательское поведение. Первичный анализ раздражителей с помощью О.Р.
очень высок, а двигательная реакция поддается точной регистрации.
Одновременно с двигательным компонентом
ориентировочно-исследовательской реакции проявляется и вегетативная
деятельность (дефекация, мочеиспускание, почесывание, умывание и др.), которая
также поддается количественному учету.
Изменения унитарных поведенческих реакций под влиянием
различных химических соединений позволяют предполагать и нарушения в половом
поведении животных.
Половое поведение может быть определено как совокупность
поведенческих актов, обеспечивающих возможность спаривания особей. При более
широком рассмотрении вопроса к половому поведению следует отнести такие зависимые
от пола реакции, направленные на воспроизводство потомства, как материнский и
гнездостроительный инстинкты.
Изучение полового поведения следует проводить для оценки
отдаленных последствий при воздействии соединений, обладающих выраженной
специфической активностью и влияющих на состояние центральной нервной и
эндокринной систем.
Так, показано, что андрогены при воздействии на беременных
самок оказывают маскулинизирующее действие на женское потомство, проявляющееся
как в анатомических дефектах урогенитальной области самок, так и в нарушении
полового поведения самок и их партнеров - интактных самцов (Goung и соавт.,
1964; М.И. Голубева и соавт., 1977).
Большая численность поведенческих методик, основанных на
исследовании поведения вообще и О.Р. в частности, обусловила необходимость
систематизировать, провести сравнительную оценку их информативной значимости,
выявить и предложить для широкого применения в токсикологических исследованиях
ряд наиболее современных высокочувствительных, адекватных и простых в исполнении
поведенческих тестов, характеризующих в своей сущности регулирующую,
интегрирующую, координирующую и коррелирующую функции центральной нервной
системы.
При выборе методов исследования поведенческих реакций
предпочтение следует отдавать чувствительным, доступным и нетрудоемким методам,
физиологичным в своей основе. Наиболее доступными для измерения параметрами
являются двигательная активность и двигательная координация животных. Из набора
простых поведенческих методик для токсикологических исследований в настоящее
время рекомендуются:
1) определение двигательного «вертикального компонента»;
2) горизонтальная и вертикальная двигательная активность;
3) «норковый рефлекс»;
4) изучение двигательной координации при вращении;
5) комплексная оценка поведения (вертикальная и
горизонтальная активность, число заглядываний в норки, эмоциональная
реактивность).
Большим преимуществом указанных методов является доступность
оборудования.
I.
ЭТАПЫ ИССЛЕДОВАНИИ
Экспериментальное изучение поведенческих реакций в
токсикологии состоит из трех этапов:
I. подготовительного;
II. исследовательского;
III. статистической обработки экспериментальных данных.
Подготовительный этап включает:
1) выбор животных и подготовку условий их содержания,
2) установление типа высшей нервной деятельности животных,
3) определение «фона» поведенческих реакций:
3.1. выработку и закрепление условных рефлексов;
3.2. установление нормального фона поведенческой
деятельности животных.
И. Исследовательский этап Включает использование конкретных
методов и динамическое наблюдение за показателями поведения.
III этап включает правильный подбор и применение методов
статистической обработки экспериментальных данных.
1. ПОДГОТОВИТЕЛЬНЫЙ ЭТАП
1. Выбор животных и условия их содержания.
В зависимости от условий опыта (острые, подострые или
хронические), животные отбираются по возрасту и массе тела. Например, белые
крысы и мыши должны иметь следующие параметры:
Таблица
1.
|
Условия
опытов
|
Возраст
животных (мес.)
|
Масса
тела (г)
|
Температура
тела*, ректальная, 0 °С (крыс)
|
|
крысы
|
мыши
|
|
Хронические
|
2
- 3
|
150
- 180
|
18
- 20
|
37
- 38
|
|
Подострые
|
3
- 4
|
180
- 220
|
18
- 22
|
«
»
|
|
Острые
|
4
- 6
|
220
- 280
|
20
- 28
|
«
»
|
________
*Некоторые
авторы относят температурную реакцию к поведенческой, так как она отражает
состояние центра терморегуляции.
Особое внимание обращают на внешний вид животных (блеск
шерстных покровов, опрятность, отсутствие внешних признаков болезни, дефекты
онтогенетического развития и т.п.).
Работать необходимо с половозрелыми особями генетически
чистых линий - Вистар и др., а при отсутствии таковых - с беспородными
животными. В качестве генетического стандарта мышей рекомендуется линия SHK.
На всех этапах изучения поведения животных должны строго
соблюдаться одинаковые условия их содержания, ухода, исследований:
1) постоянная экспериментальная обстановка (отдельное
помещение со стандартным освещением, изолированное от посторонних
раздражителей),
2) не более 1 - 2 экспериментаторов-исследователей,
3) полноценный пищевой рацион, богатый витаминами,
4) одинаковое время кормления и исследования с учетом
биоритмов поведенческих реакций,
5) содержание животных в клетках в количестве не более 10
особей одного пола.
6) четкая маркировка каждого животного,
7) обработка переносного оборудования или закрепление его за
каждой экспериментальной группой.
Исследования с помощью метода «открытое поле» проводятся в
затемненном помещении. При измерении двигательной активности требуется
проводить тщательную обработку площади манежа во избежание воздействия
запаховых раздражителей, особенно при работе с разным полом животных. Для
каждого эксперимента при определении поведенческих реакций желательно выделить
отдельную группу (количество животных подбирается в зависимости от
вариабельности показателя, но не менее 12 в группе) на каждый метод, так как в
процессе исследования может утрачиваться «новизна раздражителя».
Наблюдение полового поведения нужно проводить в специальной комнате,
в которой присутствуют только экспериментаторы (1 - 2 человека) и животные. Для
наблюдения удобно использовать специальные клетки с передней стеклянной
стенкой.
Для проведения эксперимента следует отбирать половозрелых
здоровых животных. При этом необходимо учитывать влияние индивидуального опыта
животных. Известно, что самцы крыс, имеющие опыт спаривания,, предпочитают
запах самок в эструсе запаху самок, не готовых к спариванию (Beach, 1947). У
самцов, не имеющих соответствующего опыта, а также у кастрированных самцов,
такого предпочтения не отмечалось, Следует иметь в виду, что готовность к
спариванию и стремление контактировать с самцами у самок проявляется только в
период проэструса и эструса (Eliasson, Meyerson, 1975). Кроме того, в эксперименте
не рекомендуется отбирать животных, выращенных в изоляции, так как по данным
некоторых исследователей (Gerall и соавт., 1967) это
резко снижает их способность к спариванию по сравнению с теми животными,
которые имели возможность контактировать с особями своего вида.
Наилучшее время наблюдения полового поведения - 23 - 24 - 1,
час, поскольку у животных, ведущих ночной образ жизни (к которым относятся
грызуны), в этот период наступает пик активности. В целях приближения ко
времени пика активности наблюдение можно проводить через 5 - 6 часов после
наступления темновой фазы. Для осенне-зимнего сезона это 21 - 23 часа.
В процессе отбора животных определяется тип высшей нервной
деятельности каждой особи в отдельности, так как возникновение и развитие
патологии химической этиологии связано с состоянием возбудительного и
тормозного процессов. Установлено, что уже в первых опытах поведение крыс имеет
разнонаправленный характер: у активных отмечается явно выраженная ориентировочно-исследовательская
реакция на неизвестную обстановку, в результате чего они быстро находят пищевое
подкрепление (в случае выработки условных рефлексов). Животные с преобладанием
пассивно-оборонительной реакции на новые ситуационные условия (отмечается
выраженный вегетативный компонент) должны быть из опыта исключены.
Для определения типологических особенностей большое значение
имеет также время появления рефлекса, скорость закрепления его и устойчивость,
величина и длительность рефлекса, скорость угашения и восстановления.
Комплекс перечисленных качественных характеристик должен
дать экспериментатору представление о типе высшей нервной деятельности
животных.
Если группа подопытных животных состоит из особей разных
типов высшей нервной деятельности, необходимо, чтобы и животные контрольной
группы состояли из такого же количества и обладали такими же показателями
нервной деятельности.
Наиболее приемлемым видом лабораторных животных,
используемых для изучения поведения при действии токсичных веществ, являются
крысы белые. Большинство применяемых камер конструкции Л.И. Котляревского, Ю.П.
Фролова, Н.С. Правдина и др. рассчитано именно на данный вид животных. Наиболее
широко используется двигательно-пищевая методика на крысах в камере Л.И.
Котляревского с объективной регистрацией показателей (в различных
модификациях). Принцип методики заключается в выработке на основе безусловного
пищевого рефлекса условного двигательного рефлекса на звуковой, световой или
комбинированный раздражитель. Выработку условных рефлексов в камерах такого
типа начинают с угашения ориентировочного рефлекса на новую для животного ситуацию.
Для этих целей каждую особь ежедневно помещают в камеры на 10 - 15 минут. В
течение 1 - 2 дней крысы привыкают к обстановке и с помощью экспериментатора
обучаются открывать дверцу кормушки и брать корм. Предварительно, в течение 24
часов животных лишают пищи, за исключением молока, которое дают из расчета 10
мл на одно животное 1 раз в сутки. Для пищевого подкрепления лучше всего
использовать хлебные шарики из свежего хлеба, пропитанные витаминизированным
рыбьим жиром. Размер и масса хлебных шариков должны быть, по возможности,
одинаковыми (около 1 г). В последующем, после угашения ориентировочного
рефлекса (на 3 - 4 день), приступают к выработке и закреплению положительного
рефлекса на корм: животное приучают самостоятельно открывать дверцу кормушки и
брать пищу. Добившись упрочения рефлекса на кормушку (требуется 1 - 2 Дня),
приступают к выработке положительного условного рефлекса на звук (зуммер
частотой 400 или 800 гц). Длительность звука - 5 сек. после чего следует
пищевое безусловное подкрепление. В дальнейшем, спустя 3 - 5 дней дается
условный раздражитель и животное одновременно получает подкормку. В случае,
если животное быстро реагирует на пищевое подкрепление (в среднем требуется 5 -
8 сеансов), проводят отставление условного сигнала от безусловного
подкрепления, постепенна увеличивая его до 5 сек. Условный рефлекс на звук
считается выработанным и закрепившимся, когда на подачу 10 условных
раздражителей, животные отвечают 10 положительными реакциями. В среднем, на всю
подготовку требуется 3 - 4 недели. Следующим этапом является выработка
положительного условного рефлекса на световой раздражитель (эл. лампочка
напряжением 6 вольт), которая проводится аналогично вышеописанному.
Чтобы не произошло угашение на звуковой раздражитель, каждый
сеанс в дальнейшем начинают с подачи звука, а в последующем подаются световые
сигналы. Образование и закрепление положительных условных рефлексов на звук и
свет осуществляют до тех пор, пока длительность латентного периода, величина и
общее время рефлекса будут стабильны на оба раздражителя. После этого можно
приступить к выработке дифференцировки: условный сигнал (звук), но не
подкрепляемый безусловным (пищевым) раздражением. В связи с трудоемкостью
(Вдвое больше времени), в Настоящее время большинство исследователей исключили
этот этап из схемы изучения условнорефлекторной деятельности животных.
Угашение рефлексов производят на один из раздражителей (звук
или свет) следующим образом: как обычно, положительный раздражитель
подкрепляется, а затем пищевое подкрепление отсутствует. Животное вначале
по-прежнему реагирует на раздражитель, но при отсутствии подкрепления идет
постепенно (за 12 - 25 сочетаний) угашение рефлекса. Принято считать, что
рефлекс угашен, если животное не отвечает на раздражитель 5 - 10 раз подряд.
После исчезновения положительного условного рефлекса тотчас преступают к его
восстановлению, т.е. положительный раздражитель подкрепляется.
Рефлекс считается восстановленным (в среднем 2 - 5
сочетаний), если животное 5 раз подряд отвечает на положительный раздражитель.
Функциональное состояние центральной нервной системы
характеризуют такие показатели, как:
1) скорость появления и закрепления положительного условного
рефлекса на раздражитель (число сочетаний);
2) длительность скрытого периода рефлекса (сек.);
3) величина скрытого периода (условн. ед.);
4) время рефлекса (сек.);
5) количество толчков дверцы и кормушки;
6) % выпадения положительных рефлексов;
7) скорость угашения и восстановления условных рефлексов
(число сочетаний).
Исходные показатели условнорефлекторной деятельности (фон)
перед затравкой проверяют на стабильность: проводят 10 - 12 сеансов 3 дня
подряд. В норме высшая нервная деятельность крыс характеризуется следующими
параметрами:
1) длительность скрытого периода - 0,60 ÷ 2,00 сек.
2) величина рефлекса - 150,0 ÷ 250,0 уел. ед.
3) время рефлекса - 2,00 ÷ 3,00 сек.
4) количество толчков дверцы кормушки - 1 - 2.
Биологическая значимость показателей условнорефлекторной
деятельности, определенная с помощью коэффициента вариации (v), составляет
соответственно: 19 %; 21,3 %; 14,4 %; 15,6 %, что дает право отнести эти
константы к пластичным.
Для регистрации этих показателей в усовершенствованной камере
Л.И. Котляревского используют блок-приставку программного управления, состоящую
из электронных счетчиков импульсов*).
_______
*Рационализаторское
предложение № 41 от 17. V. 75 г. Цапко В.Г. и соавт.: КНИИГТиПЗ.
Перед динамическими исследованиями простых поведенческих
тестов также необходимо «фоновое» обследование и тщательный подбор групп.
Метод «вращающегося конуса» требует предварительной (3 раза)
тренировки животных с целью исключения возможных генетических нарушений
двигательной координации и вестибулярного аппарата.
Применение «комплексной» установки для одновременного
определения вертикального и горизонтального компонентов двигательной
активности, «норкового» рефлекса и эмоциональной реактивности требует
исключения из опыта «горизонтального» поведенческого типа животных с
отсутствием вертикальной двигательной активности, т.е. с преобладанием
пассивно-оборонительной реакции на новые условия обстановки.
При проведении исследований необходимо учитывать
физиологические колебания поведенческих показателей в зависимости от времени
суток и пола животных.
Для оценки подученных изменений с точки зрения критерия их
вредного действия, следует учитывать уровень физиологических колебаний и
принимать во внимание коэффициент вариации.
Некоторые показатели поведения в норме представлены на табл.
2.
Параллельно с установлением фона условнорефлекторной
деятельности, как правило, определяют и другие показатели, характеризующие
общеповеденческий фон: «горизонтальную» и «вертикальную» активность животных,
способность центральной нервной системы суммировать подпороговые импульсы,
состояние вегетативных реакций и др.
Исследование показателей поведения животных лучше всего
проводить спустя 30 - 60 мин. после затравки, поочередно из подопытной и
контрольной группы.
Помещения, где проходят физиологические опыты -
условнорефлекторные комнаты - должны быть оборудованы специально для этих
целей: исключены посторонние раздражители (световые, звуковые и т.п.), воздух
не должен содержать посторонних запахов.
Поведенческие реакции у подопытных и контрольных животных
должны изучаться не реже одного раза в неделю с регистрацией результатов в
протоколах исследований (приложение 1, 2).
При выработке «лабиринтных» условных рефлексов используют аналогичную схему
исследований.
Большое распространение в токсикологических исследованиях
получил простой и чувствительный метод, с помощью которого определяется
способность центральной нервной системы суммировать подпороговые импульсы.
Коэффициент вариации указанного показателя равен 28 - 30 %
(пластичный показатель). Указанный метод подробно изложен в рекомендациях С.В.
Сперанского (1975).
УРПИ по своей информативности уступает классическому
условнорефлекторному методу изучения функционального состояния ЦНС, но
значительно менее трудоемок,
УРПИ позволяет изучить основные
закономерности образования условного рефлекса, оценить влияние токсичного
агента на процессы формирования, фиксации и воспроизведения временных связей.
Образование условного рефлекса (У. Р.) избегания как и любого рефлекса можно
представить в следующем виде:
|
обучение
→
|
консолидация
временной связи →
|
механизмы
хранения →
|
воспроизведение
У.Р.
|
При затравке животных сразу после
обучения токсичный агент воздействует на наиболее ранимое звено
условнорефлекторной связи, на процесс консолидации, процесс перехода
краткосрочной памяти в долговременную.
При более отставленной затравке (> 1 часа после
обучения), когда основные процессы консолидации завершены, токсичные агенты
нарушают механизмы хранения и воспроизведения условного рефлекса. В случае
обучения животных после затравки (на фоне действия химического агента)
оценивается способность ЦНС к образованию условнорефлекторных связей различной сложности
(совпадающий и следовой У.Р.).
В основе УРПИ при применении методики в модификации Р.И.
Кругликова лежит экологически обусловленное предпочтение сумеречными животными
- крысами и мышами - темноты свету.
Установка для выработки УРПИ состоит из освещенного
«безопасного» отсека и затемненного «опасного» отсека с электрофицированным
полом (приложение 7). Для
выработки условного рефлекса крысу или мышь помещают в освещенную камеру
установки хвостом к отверстию, соединяющему оба отсека. Переход животного в
затемненный отсек сопровождается электрокожным раздражением при напряжении 40 -
60 вольт, продолжающемся до возвращения животного в освещенный отсек. На этом
выработка условного рефлекса заканчивается и крыса (мышь) извлекается из
установки. В процессе эксперимента фиксируется время пребывания животного в
освещенном отсеке. При проверке сохранения рефлекса (в зависимости от условий
эксперимента, в различное время после обучения и затравки) опыт проводится
аналогично выработке рефлекса, только переход животного в темный отсек не
сопровождается электрокожным раздражением и крыса (мышь) сразу извлекается из
установки.
При проверке сохранения рефлекса максимальное время
пребывания животного в освещенном отсеке установки ограничивается
экспериментатором (180 - 500 сек).
Как показал наш опыт, можно ограничиться 3-минутным
пребыванием животного в освещенном отсеке. До обучения время пребывания
животных в освещенном отсеке составляет 11,9 ± 0,4 сек. Коэффициент вариации
3,7 %. Сравнивается время пребывания в светлой камере после обучения животных
опытной и параллельной контрольной групп (по 15 - 20 крыс в группе). При
выраженной амнезии УРПИ целесообразно применение приема «напоминания» (животные
подвергаются воздействию электрического тока, напряжением 60 В в течение 5 - 10
сек.).
Образование отставленного условного рефлекса избегания
производится аналогично вышеописанному, только удар током следует на 10 - 15
сек. пребывания животного в темном отсеке установки.
Одним из интегральных показателей, отражающих функциональное
состояние ЦНС, служит спонтанно-двигательная активность. Для ее определения
используют различного рода актографы, впервые рекомендованные М. Хорватом
(1965), площадку «открытое поле», лабиринт и т.д. и учитывают горизонтальную и
вертикальную составляющие двигательной активности животных за определенный
период времени (1 - 10 минут). При изучении активности над площадкой
лабиринтной камеры помещают источник света. На дне площадки размещают на
одинаковом друг от друга расстоянии фото-воспринимающие элементы -
фоторезисторы.
При перемещении животного по лабиринту пройденный им путь
(спонтанно-двигательная активность) определяется как произведение количества
фотоимпульсов на расстояние между двумя соседними фотоэлементами. Мера
изменчивости составляет 27 - 34 % (II категория,
пластичный показатель),
Предлагаются следующие методы, основанные на количественной
регистрации поведенческих реакций:
4.1. Определение «вертикальной» двигательной активности в
ограниченном пространстве.
4.2. Метод открытой площадки («норковый» рефлекс).
4.3. Метод «открытого поля».
4.4. Метод «вращающегося конуса».
4.5. Комплексный метод с интегральной оценкой поведенческих
параметров («открытое поле» + «норковый» рефлекс).
Определение «вертикального» двигательного компонента
ориентировочной реакции основано на подсчете количества вставаний животных на
задние лапы (вертикальных стоек крыс или мышей) в ограниченном пространстве: в
банке, коробке или манеже за определенное время, 1 - 10 мин.
В литературе приводятся сведения о высокой чувствительности
«вертикального компонента» ориентировочной реакции для крыс (Р.А. Хаунина, 1969
и др.).
Для стандартизации исследований рекомендуется определять
«вертикальную» двигательную активность у мышей в специальной установке из
органического стекла с отверстиями для обменной вентиляции в течение 1 мин.
Высота установки 350 мм, диаметр 130 мм (см. приложение 5). При работе с крысами размеры установки следующие:
высота 400 мм, диаметр 200 мм. После каждого животного следует тщательно
протирать дно ватным тампоном. Указанный метод может служить объективным
интегральным показателем общего состояния животных. Сезонные колебания указанного
показателя незначительны, хотя наибольшая активность наблюдается весной;
достоверны половые различия: у самок мышей число вертикальных стоек за 1 мин. М
± m = 12,46 ± 0,59, у самцов - 9,95 ± 0,49; у самок
крыс - 8,7 ± 0,69; у самцов - 5,6 ± 0,65.
Коэффициент вариации показателя v составляет 31,4 %
(пластичные показатели, II категория).
Для целей токсикологического эксперимента рекомендуется
модифицированный метод определения ориентировочной реакции на открытой площадке
(Boissier с соавт., 1964). Животное (крыса) помещается в центр горизонтальной
установленной площадки размером 60×60 см, на которой равномерно
расположены 16 отверстий диаметром 4 см. Для мышей размер площадки 40×40
см, отверстия имеют диаметр 3 см (см. приложение 5). Высота площадки 20 см. Площадку Следует
изготавливать из оргалита, фанеры или органического стекла с белым
гигиеническим покрытием; подставка металлическая, съемная. В течение 3 мин
визуально подсчитывается количество заглядываний в отверстия - норки.
Предлагаемый способ определения ориентировочной реакции физиологичен, в основу
его положен «норковый рефлекс» грызунов. Высокая специфичность метода показана
при изучении нейротоксического действия химических веществ на примере фталатов
и карборанов (Е.С. Балынина, И.В. Березовская, 1976).
Метод рекомендуется в качестве интегрального показателя.
У самок двигательная активность выше, чем у самцов. У самок
мышей количество заглядываний в норки за 3 мин. составляет М ± m = 22,65 ± 0,8;
у самцов 18,97 ± 1,19; у самок крыс 12,0 ± 1,3; у самцов 8,5 ± 0,75.
Коэффициент вариации показателя двигательной активности («норкового» рефлекса)
методом открытой площадки составляет v = 30,8 % (II категория, пластичные показатели).
Метод «открытого поля» широко, применяется при изучении
поведенческих реакций в фармакологии, психогенетике, зоопсихологии и
заключается в исследовании двигательного компонента ориентировочной реакции и
эмоциональной реактивности животных. Автором метода является Hall (1934). Д.А.
Кулагин (1969) с успехом применил «открытое поле» для исследования поведения
крыс разных линий. Метод «открытого поля» на мышах основан на исследовании в
манеже, в затемненном помещении. Наблюдение за животными проводится строго в
одном и то же время суток в течение 2 мин. при постоянной местной освещенности
манежа во время опыта лампой 500 вт с зеркальным отражателем (см. приложение 5). Высота лампы над центром
манежа 60 см, диаметр манежа 80 см, высота бортика из зеркальной жести 35 см.
Основание манежа изготавливают из дерева или оргалита, покрывают белой
водоотталкивающей краской и расчерчивают черными линиями на 16 квадратов
(секторов). Животные (мыши или крысы) предварительно размещаются по 1 в коробке
и спустя 5 - 10 мин. поступают на опыт в манеж.
Визуально подсчитывается количество пересеченных (4 лапами)
квадратов при спонтанном перемещении животного и вычисляется длина пробега в метрах
i = к×n, где
i - длина пробега в метрах;
к - коэффициент пересчета - 0,15 (по расчету, исходя из
размера и количества квадратов);
n - количество пересеченных при
движении квадратов. Размер квадрата 20×20 см.
Длина пробега характеризует уровень двигательной активности
животных. У мышей учитываются только горизонтальные пробежки, у крыс отчетливо
выражен горизонтальный и вертикальный компоненты двигательной активности.
Одновременно при обследовании учитывается реакция дефекации по количеству
фекальных шариков, которая расценивается как эмоциональная реактивность
животных. У мышей длина пробега за 2 мин. составляет в метрах: у самок 4,5 ±
0,18; у самцов 3,3 ± 0,13; у самцов крыс 5,21 ± 0,29, у самок 6,0 ± 0,2.
Коэффициент вариации показателя двигательной активности,
определенной в открытом поле, составляет 20 - 28 %.
Эмоциональная реактивность у самцов выше, чем у самок (у
мышей соответственно 1,47 ± 0,1 и 0,56 ± 0,04). v составляет 36,6 % (весна,
самки) и 39,3 % (весна, самцы), а также 44,6 % (осень, самки) и 51,2 % (осень,
самцы), то есть эмоциональная реактивность при этом методе выявляется как
пластичный показатель.
В отличие от статического показателя времени удерживания на
«вращающемся стержне», при вращении конуса животное совершает активное
поступательное движение вдоль винтовой разделительной перегородки; двигательная
координация оценивается как динамический показатель. Инженерный принцип
конструкции «конуса» предложен датскими исследователями (Jacobsën. 1970).
В отделе токсикологии ИГТиПЗ (Москва) создан прибор с
шестеренчатым редуктором на 4 скорости вращения: 10, 15, 20 и 30 об/мин с целью
использования различных скоростей вращения конуса в качестве функциональной
нагрузки. Устройство «вращающийся конус» представляет собой горизонтально
расположенный конус, выполненный из дюраля.
Длина конуса 1250 мм, диаметр от 35 до 115 мм. Общий вид
устройства «вращающийся конус» изображен на рис. 4 (см. приложение 6). Конус приводится во вращение приводом от
электрического двигателя СД-54 с шестеренчатым редуктором, 4 шестерни с
различным набором зубцов расположены на валу конуса и 1 шестерня на валу электрического
двигателя. Поскольку шестерни изготавливаются заранее со строго определенным
постоянным набором зубцов, разовая выборка скорости производится согласно
тахометру. Переключением рукоятки шестерни устанавливаются в одно из 4-х
рабочих положений, обеспечивая вращение вала конуса со скоростью 10, 15, 20 и
30 об/мин*, (приложение 4).
________
*Рационализаторское
предложение № 274 Балынина Е.С 22.11.78 г., ИГТиПЗ, Москва.
Поскольку прибор питается от сети переменного тока (220 в),
корпус установки заземляется, а оператор должен пройти инструктаж по технике
безопасности при работе с устройствами, питающимися от электрической сети.
Разделительная винтовая стенка - перегородка из алюминия,
расположенная по спирали, заставляет животное активно двигаться вдоль конуса по
направлению увеличивающегося диаметра. Поверхность конуса обклеена вакуумной
резиной 1 - 1,5 мм толщиной для удерживания животных при вращении вала.
Когда мыши уже не могут сохранять равновесие при движении на
вращающемся конусе, они падают в один из 10 ящиков, размещенных под конусом.
Окончание опыта регистрируется номером ящика, в который падает мышь. Для
удобства и стандарта измерений предлагается оценивать уровень двигательной
координации в условных единицах (баллах) от 0 до 9, соответствующих номеру
ящика. Мышь, падающая в ящик № 9, показывает наибольший уровень двигательной
координации. Ящик № 0 - отсутствие координации.
Необходимо проводить предварительный отбор для исключений
возможных генетических нарушений равновесия и двигательной координации и
3-кратную подготовительную тренировку животных в течение 3-х Дней; на каждое
измерение затрачивается ~ 20 сек., берется среднее показание из 3-х проб. После
3-х тренировочных испытаний животное достигает постоянного уровня двигательной
координации, равного 8 - 9 баллам. Животные, имеющие показатель 0 - 4 балла при
1-й тренировке (при V = 10 об/мин) отбраковываются н не должны использоваться в
последующих опытах (10 % ♂ - 20 % ♀). Физиологические колебания
двигательной координации у интактных мышей составляют М ± 26 = 8,5 ± 0,48 после
отбора и трех тренировочных испытаний при скорости вращения - 10 об/мин. Такая
жесткая «норма» свидетельствует о резервных возможностях организма переносить
функциональные нагрузки в виде больших скоростей, v = 2,8 % позволяет оценить
этот показатель как высокоинформативный жесткий показатель I-й категории.
Высокая чувствительность заложена в биологической значимости самого признака и
дополнительно выявляется с помощью применения функциональной нагрузки в виде
скорости вращения.
Двигательная координация у самцов стабильнее, чем у самок
примерно в 2 раза (при отборе).
Для экономии времени исследования и одновременной
регистрации нескольких параметров предлагается устройство для комплексного
измерения поведенческих реакций, основанное на применении методов «открытого
поля» и «норкового рефлекса». Предлагается измерять 5 отдельных параметров и
производить интегральную оценку суммарной активности при помощи ручного
8-клавишного механического счетчика. Для этой цели используется заводской
счетчик для подсчета клеток периферической крови человека - клавиши
приспособлены для количественного учета поведенческих параметров. Установка
(см. приложение 6)
представляет собой 8-гранный настольный манеж - коробку с прозрачными стенками
из органического стекла (h = 200 мм, 1грани = 150 мм). Основание манежа
расчерчено на сектора соответственно количеству граней (8). В центре манежа
находится полый 4-грайник из орг. стекла, h = 200 мм, 1грани = 80
мм; в каждой грани которого у основания вырезаны отверстия - «норки» d = 20 мм
(всего 8 отверстий). Животные (белые мыши) по одному помещаются в манеж и
одновременно за 3 мин. измеряется (регистрация производится ручным нажатием
клавиш механического счетчика) отдельно: двигательная активность по количеству
пересеченных при движении секторов и числу вертикальных стоек животного;
ориентировочно-исследовательская реакция по количеству заглядываний в
норки-отверстия; эмоциональная реактивность по числу фекальных шариков за время
опыта. Кроме того, на счетчике получаем результирующую цифру - сумму
активностей в качестве интегральной оценки активности животного за время
наблюдения. Таким образом, одновременно производится качественная и
количественная оценка отдельных параметров (замеряются величины отдельных
параметров и их соотношение) и определяется интегральный показатель общей
активности (результирующая цифра на счетчике) - всего 5 параметров.
Помимо учета общего количества заглядываний в норки
показательным является заход животного в домик, который является чувствительным
показателем исследовательского поведения и рекомендуется к использованию.
При нейротоксическом действии наиболее чувствительным
является «вертикальный» компонент двигательной активности и параметры
исследовательского поведения (заглядывание в норки и заход в домик),
«горизонтальная» двигательная активность отличается стабильностью. Поэтому
рекомендуется наряду с интегральной оценкой всей активности животного учитывать
соотношение активностей, которое позволяет установить определенные
закономерности и выраженность токсического действия химических соединений.
После каждого измерений необходимо протирать манеж тампоном
с разбавленным спиртом (50 %) для уничтожения «запаховых» раздражителей.
Для целей обработки полученных результатов предлагается
форма рабочего протокола (приложение 3).
Установлено (мыши-самцы, сезон весна, n
= 190), что горизонтальный компонент двигательной активности составляет М ± m = 32,1 ± 1,73; вертикальный компонент двигательной
активности М ± m = 18,2 ± 1,1; «норковый рефлекс» по
количеству заглядываний в норки М ± m = 13,2 ± 1,0;
интегральная активность М ± m = 64,9 ± 2,5 (табл. 2).
Для изучения полового поведения рекомендуется использовать
специальные клетки со стеклянной передней стенкой (38×38×24 см).
Экспериментальных крыс-самцов, имеющих опыт садок, помещают
в клетки на 1 - 2 часа для наблюдения.
Самок (в стадии эструс!) следует подсаживать в клетку к
самцу (а не наоборот). Предварительно самок необходимо рассадить в клетки по
одной на 10 - 20 мин. Чрезвычайно важным является содеожание животных разного
пола в отдельных помещениях или на значительном расстоянии друг от друга, так
как половое поведение в значительной степени определяется запаховыми раздражителями.
Таблица 2
Показатели поведенческих реакции у интактных животных
|
Метод
исследования
|
Определение
«вертикального вставания»
в
ограниченном пространстве
|
Открытая
площадка («норковый рефлекс»)
|
«Открытое
поле»
|
«Вращающийся
конус»
|
Комплексный
метод
с
интегральной оценкой
поведенческих
параметров
(«открытое
поле» + «норковый рефлекс»)
|
|
Время
измерения
|
1
мин
|
3
мин
|
2 мин
|
20
сек
|
3
мин
|
|
Вид
и количество животных
|
М
400♀
160♂
|
КР
120♀
120♂
|
М
160♀
160♂
|
КР
180♀
160♂
|
М
350♀
300♂
|
КР
120♂
|
М
140♀
160♂
|
М
190♂
|
|
М
± m ♀
|
12,46 ± 0,59
|
8,7 ± 0,68
|
22,65 ± 0,8
|
12,0 ± 1,3
|
4,5 ± 0,18
|
0,56 ± 0,04
|
|
|
|
М
± m ♂
|
9,95 ± 0,49
|
5,6
± 0,65
|
18,97 ± 8,5
|
8,5 ± 0,75
|
3,3
± 0,13 ±
|
1,47 ± 0,1
|
5,21 ± 0,29
|
8,5 ± 0,13
|
Горизонт.
двигат. активы. 32,1 ± 1,73
|
Вертик. двиг. активн. 18,2 ± 1,1
|
«Норковый рефл.»
13,2 ± 1,0
|
Интегр.
активн. 64,9 ± 2,5
|
|
|
31,4
|
30,8
|
ДА = 20 - 28
ЭР
= 36 - 50
|
2,8 ÷ 5,6
|
23,0
|
26,3
|
33,3
|
16,9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Условные обозначения: М - мыши; КР
- крысы; ДА - двигательная активность; ЭР - эмоциональная реактивность
Для оценки полового поведения крыс рекомендуются следующие
экспериментальные модели:
I подопытный самец + интактная самка
II подопытная самка + интактный самец
III подопытный самец + интактный самец
IV подопытная самка + интактная самка
V подопытный самец + подопытная самка
Модели III и IV рекомендуется применять при изучении половых
гормонов или веществ, обладающих аналогичными свойствами.
Модель V следует использовать лишь в случае выявления
нарушений в половом поведении особей обоего-пола.
При оценке полового поведения самцов следует регистрировать:
1) Латентный период интромиссий - время от момента подсадки
самки в клетку к самцу до момента первой садки самца. Этот период составляет от
нескольких секунд до 5 - 6 мин.
2) Число садок до наступления эйякуляции. При этом следует
различать: а) простую садку (приближение самца к самке и охватывание передними
лапками её боком); ориентировочное число таких садок от 0 до 3;
б) садку с прижиманием (простая садка + тазовое касание
задними конечностями самца задней нижней части тела самки); от 1 до 6 садок;
в) садку с «интромиссиями» (садка с прижиманием + энергичные
прижимания тазовой части тела самца при быстром вспрыгивании, заканчивающееся
при успехе введением пениса во влагалище); в зависимости от индивидуальных
особенностей животного возможны колебания от 8 до 29 садок, в большинстве случаев
наблюдается 12 - 16 садок. Коэффициент вариации составляет 48 %.
В процентном отношении из общего числа садок до эйякуляции
на долю простых садок приходится 9 - 10 %, садки с прижиманиями занимают от 10
до 20 %, садки с интромиссиями, как правило, составляют 70 - 80 %.
После садок с интромиссиями у самца наступает эйякуляция.
Эйякуляция определяется по наличию сперматозоидов во
влагалищном мазке самки или, косвенно, по поведению самца, который после серии
интромиссий утрачивает интерес к самке и успокаивается.
3) Латентный период эйякуляции - период времени от начала
садок до эйякуляции (от 5 до 25 мин., в среднем 10 мин.). Коэффициент вариации
v = 45 %.
4) Рефрактерный период (период покоя) между эйякуляцией и
последующей серией садок (от 4 до 11 мин., в среднем 6 - 7 мин.). Коэффициент
вариации показателя составляет 25 %.
Для более полной характеристики половой функции самцов
целесообразно регистрировать серию эйякуляций до полного полового истощения,
что дает возможность оценить степень угасания функции. Половое истощение
подразумевает такое состояние самца, при котором в течение 30 мин. не
наблюдается садок на самку в эструсе.
При оценке полового поведения самок следует обращать
внимание на наличие лордозной реакции (поза подставления, характеризуемая изгибом
позвоночника назад с поднятием головы, опущением грудной части тела и
приподниманием крестца и основания хвоста) в ответ на каждую садку самца.
Необходимо учитывать степень выраженности лордозной реакции (0 - отсутствует, +
- слабая, ++ - выраженная) и общую длительность пребывания самки в описанной
позе (от 6 до 8 мин.). При наблюдении за самками следует отметить реакцию
избегания самца.
Для каждого животного наблюдение полового поведения должно
быть проведено не менее 3 раз (в разные дни) с интервалом от 3 до 6 дней.
Регистрация перечисленных показателей позволяет оценить
влияние токсического воздействия на половую функцию животных и состояние
механизмов, управляющих различными процессами спаривания.
При трактовке результатов следует иметь в виду возможность
возникновения следующих эффектов:
а) возбуждение половой функции;
б) ослабление половой функции;
в) инверсия направленности полового поведения;
г) изменение полового поведения, связанное с анатомическими
нарушениями у подопытного животного или партнера.
Возбуждение половой функции самцов может характеризоваться
уменьшением таких показателей, как латентный период интромиссий и эйякуляции с
постэйякуляторным рефрактерным периодом, а также увеличением числа
последовательных эйякуляций до полового истощения.
Удлинение латентного периода интромиссий и рефрактерных
периодов эйякуляции у самцов, отсутствие или слабая выраженность лордозной
самки в этой позе или избегание самца могут свидетельствовать об ослаблении
половой функции животных.
Увеличение числа садок до наступления эйякуляции, удлинение
латентного периода эйякуляции, отсутствие последней у самца может быть связано
с анатомическими дефектами урогенитальной области самок.
Для выявления закономерностей изменения комплекса
поведенческих реакций подопытных животных рекомендуется использование
множественного корреляционного анализа (Г.Ф. Лакин, 1973; Д. Сепетлиев, 1968).
С этой целью необходимо определить взаимосвязи следующих высокочувствительных показателей:
а) латентный период УР = Х,
б) Спонтанно-двигательная активность - У,
в) суммационно-пороговый показатель - Z.
Для адекватного отражения причинно-следственных связей в начале
эксперимента и в процессе затравки через определенные интервалы времени (0,5;
1; 2; 3; 4 и 4,5 месяца) рассчитываются следующие показатели корреляционного
анализа: совокупный, парные и парциальные коэффициенты корреляции, стандартные
ошибки коэффициентов, критерии достоверности, а также выводятся уравнения
регрессии для моделирования зависимости между изучаемыми показателями й
вышеуказанные периоды затравок (Е.Н. Буркацкая, В.Ф. Витер, 1981).
Расчеты проводятся на компьютерах по составленным алгоритмам
для трехфакторных корреляционных комплексов. Ниже приводятся использованные
алгоритмы вычисления математических критериев.
На первом этапе расчетов в каждом комплексе определяются
парные коэффициенты корреляции по формулам (1
- 3).
где - rху, xz,
yz - парные коэффициенты корреляции между факторами х и у, х и z, у
и z:
х, у, z - конкретные значения факторов (получены в
эксперименте);
х - латентный период УР;
y - СДА;
z - СПП;
n - количество животных в группе.
Полученные парные коэффициенты
корреляции оцениваются самостоятельно при анализе попарных взаимосвязей факторов
в вышеуказанные периоды затравок, а также используются на втором этапе расчетов
для вычисления совокупных коэффициентов корреляции. Применяется формула (4), удобная для машинной обработки:
|
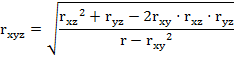
|
(4)
|
где rxyz
- совокупный коэффициент корреляции;
rxy, rxz,
ryz - парные коэффициенты корреляции.
Совокупный коэффициент корреляции является интегральным
критерием, позволяющим оценить степень координации изучаемых поведенческих
реакций животных, выявить время появления первых признаков расстройства
поведения животных и регистрировать (используя для этого чувствительные
биохимические, гематологические и другие методы) наиболее ранние признаки
неблагоприятного действия химических соединений.
Определение в экспериментах так
называемого «чистого» взаимодействия пар изучаемых поведенческих реакций
животных проводится с помощью парциальных коэффициентов корреляции, когда
статистически исключается влияние третьего фактора. Расчеты проводятся по
формулам (5 - 7):
где rху⋅z - парциальные коэффициенты
корреляции между факторами х и у, х и z, у и z, при соответственном исключении
влияния факторов;
rху⋅z, rхz⋅y, rуzx см. обозначения выше.
Перед определением размера
парциальных коэффициентов корреляции в генеральной совокупности (доверительных
интервалов коэффициентов) предварительно рассчитываются их стандартные ошибки
по формулам (8 - 10).
где mr -
соответствующие стандартные парциальных коэффициентов корреляции.
Достоверность коэффициентов корреляции определяется с
помощью предварительно рассчитанного
t - критерия Стьюдента (11 - 13):
где t - критерии достоверности
парциальных коэффициентов корреляции;
r и m -
парциальные коэффициенты корреляции и их стандартные ошибки.
Расчет параметров уравнений
регрессий проводится путем составления и решения систем уравнений с тремя
неизвестными методами определителей относительно а, в1 и в2
(14):
где a, в1 в2
- параметры уравнения регрессии;
х, у, z - см. обозначения выше.
Полученные конкретные значения
параметров позволят вывести уравнения регрессии в виде формулы (15):
|
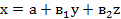
|
(15)
|
Такое уравнение показывает
направление и силу связи между факторами х, у и z, устанавливая степень
изменения параметра поведенческой реакции х при изменениях показателей
поведенческих реакций у и z на 1 единицу.
Приведенная схема множественного корреляционного анализа
является универсальной и может быть рекомендована к применению в токсикологии с
целью выявления ранних эффектов токсических воздействий, т.е. времени
наступления дискординации и несогласованности поведенческих реакций животных.
Кроме того, обработка ряда параметров поведения может быть
проведена с помощью классических статистических приемов, путем вычисления
критерия t по Стьюденту-Фишеру, а также с помощью методов непараметрической
статистики (точный метод Фишера и критерий Вилкоксона-Манна-Уитни), изложенных
в книге Е.В. Гублера и А.А. Генкина (1969).
В заключение можно сказать, что при современном уровне
знаний, в связи со сложностью поведения животных как предмета исследований, в
области применения поведенческих реакций в токсикологии целесообразно ставить
достаточно узкие задачи.
Необходимо развивать и совершенствовать биометрический
подход в изучении поведенческих реакций с объективной регистрацией результатов.
В практической работе экспериментатор должен учитывать
следующее:
1. При использовании поведенческих методов как в качестве
интегральных показателей, так и при направленном изучении функционального
состояния нервной системы, нельзя ограничиваться применением только одного
метода, желательно использовать комплекс имеющихся методов. Обязательно
определение СПП наряду с поведенческими показателями.
Избирательность поражения ориентировочно-исследовательской
реакции должна нацелить экспериментатора на возможное нейротоксическое действие,
при исследовании которого рекомендуется использование высокочувствительного
метода условных рефлексов (несмотря на его трудоемкость) и условного рефлекса
пассивного избегания.
2. Из показателей поведения наиболее информативным и
гигиенически значимым является двигательная координация с помощью метода
«вращающегося конуса», I категория жестких показателей с коэффициентом вариации
до 10 %.
3. Предлагается использовать в качестве интегрального
показателя двигательную активность животных (вертикальную и горизонтальную) при
помощи метода «открытой площадки».
Показатель эмоциональной реактивности может быть
рекомендован для исследований только с помощью метода «открытого поля». Оба
показателя относятся ко II категории пластических показателей. Для экспрессной оценки
общего состояния животных рекомендуется реакция вертикального вставания в
банке.
4. При исследовании поведенческих реакций необходимо
учитывать половые, суточные и сезонные изменения. Наибольшая активность весной,
в остальные сезоны различия не существенны. Половые различия достоверны. У
самок (крысы, мыши) двигательная активность выше, а эмоциональная реактивность
ниже, чем у самцов. Двигательная координация, наоборот, стабильнее у самцов.
Наибольшая активность в 9 час. утра и вечером после 16 час.
5. Изучение полового поведения следует проводить для оценки
отдаленных последствий при воздействии соединений, обладающих выраженной
специфической активностью и влияющих на состояние центральной нервной и
эндокринной систем.
Приложение 1
Форма протоколов опытов для регистрация
условнорефлекторной деятельности экспериментальных животных
|
Дата
|
Время опыта
|
№№ пп.
|
Маркировка животных
|
Латентный период (с)
|
Величина рефлекса (усл. ед.)
|
Длительность рефлекса (сек.)
|
Количество толчков
|
|
111211⋅11⋅1110 среднее
|
111211⋅11⋅111011 среднее
|
111211⋅11⋅111011 среднее
|
111211⋅11⋅111011 среднее
|
|
|
|
1
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
Среднее M ± m
|
|
|
|
|
|
|
P
|
|
|
|
|
|
Приложение 2
Форма протоколов опытов для регистрации
условнорефлекторной деятельности и суммационно-порогового показателя
экспериментальных животных
|
Дата
|
Время опыта
|
№№ пп.
|
Маркировка животных
|
Ориентировочно-исследовательские
поведение
|
СПП (вольт)
|
|
СДА (см) мин.
|
перелазывание через перегородки
лабиринта
|
вегетативные реакции
|
до нагрузки
|
после нагрузки
|
|
|
|
1
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
|
Среднее M ± m
|
|
|
|
|
|
|
|
P
|
|
|
|
|
|
|
Приложение 3
Форма протокола оценки поведенческих параметров у
мышей. Поведенческие показатели за 3 мин. измерения
|
Дата
|
Время
|
№№ пп
|
Двигательная активность
|
Ориентир исследов. реакция
|
Эмоциональная реактивность
|
Интегральная оценка - сумма активностей
|
|
1
|
2
|
3
|
4
|
5
|
|
горизонтальный компонент - количество
пересеченных секторов
|
вертикальный компонент - число
вертикальных стоек
|
количество заглядываний в
норки-отверстия
|
число фекальных шариков
|
|
|
|
|
|
|
|
из них заход в домик «+», выход «-»
|
|
|
|
|
|
1
|
Σ1
|
Σ2
|
Σ3
|
Σ4
|
Σ5 = Σ1 + Σ2 = Σ3 + Σ4
|
|
|
|
.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n
|
|
|
|
|
|
|
|
|
|
Среднее M1 ± m1
|
M2 ± m2
|
M3 ± m3
|
M4 ± m4
|
M5 ± m5
|
Приложение 4
Рабочая инструкция к пользованию устройством
«вращающийся конус» (для измерения двигательной координации животных)
1. Установить шестерни Z = 44 (на валу конуса) и Z = 23 (на
валу электрического двигателя СД-54) в рабочее положение, при котором зубчатая
передача обеспечивает скорость вращения вала конуса V = 10 об/мин.
2. Проверить заземление корпуса установки, включить
электрический двигатель СД-54 в сеть 220 в. При помощи тумблера, расположенного
с правой стороны корпуса установки, привести вал корпуса во вращение (положение
«включен»).
3. Индивидуальные фоновые колебания двигательной координации
замеряются непосредственно перед воздействием. На каждое измерение
затрачивается 20 сек. Одновременно на вал конуса можно помещать 5 - 6 мышей,
отдельно каждую в нулевое положение (над ящичком № 0).
4. По окончании испытаний повернуть тумблер в положение
«выключен», отключить питание эл. двигателя (выключить вилку из сети 220V).
Привести устройство «вращающийся конус» после опытов с животными в
соответствующий порядок: протереть конус чистой ватой, вымыть ящики проточной
водой.
Приложение 5
ОБЩИЙ ВИД ОБОРУДОВАНИЯ
1.
Банка (из орг. стекло)
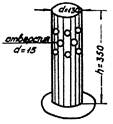
2.
Открытая площадка
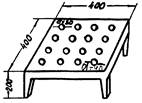
3.
Установка «открытого поля»
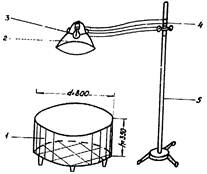
1. Манеж для животных
2. Зеркальный отражатель
3. Лампа накаливания 500 Вт.
4. Передвижной кронштейн
5. Передвижная
стойка-держатель.
Приложение 6
ОБЩИЙ ВИД ОБОРУДОВАНИЯ
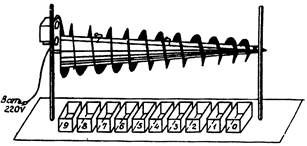
Рис. 4. Устройство «вращающийся конус»
Длина конуса 1250 мм.
диаметр от 35 мм до 115 мм.
Вращение при помощи привода от эл. двигателя
(тип CD-54) с шестеренчатым редуктором
со скоростью 10. 15, 20 и 30 об/мин.
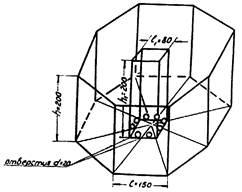
Рис.
5. Комплексная установка
для одновременной
количественной регистрации
поведенческих реакций у мышей настольный манеж
из органического стекла.
Приложение 7
Установка для выработки УРПИ у крыс.
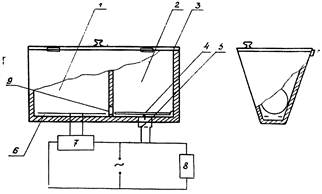
1. Темная камера (опасный отсек)
2. Светлая камера (безопасный отсек)
3. Крышка
4. Подвижна платформа
5. Микровыключатель
в. Контактные пластины
7. Источник питания
8. Измерительный прибор (электросекундомер)
9. Соединительное отверстие
Примечание; В случае отсутствия электросекундомера последний
может быть заменен обычным секундомером. В этом случае необходимость в п. 4. 5
и 8 отпадает, т.к. они служат для автоматического отсчета времени пребывания
животного в светлой камере.
|
1. Анохин П.К.
|
Очерки по физиологии
функциональных систем. М., «Медицина», 1975. 448 с.
|
|
2. Балынина
Е.С.
|
Применение метода
открытого поля в токсикологическом эксперименте. «Гиг. труда и профзабол.»,
1978, № 11, с. 56
|
|
3. Балынина
Е.С.
Березовская
И.В.
|
Сравнительная
оценка методов определения ориентировочной реакции крыс в токсикологическом
эксперименте. «Фармакол. и токсикол.», 1976. Т. XXXIX, № 5, с. 635.
|
|
4. Балынина
Е.С.
Тимофиевская
Л.А.
|
К вопросу применения
показателей поведенческих реакций н токсикологических исследованиях «Гигиена
и санитария», 1978, № 7, с, 54 - 58.
|
|
5. Буркацкая
Е.Н.
Витер В.Ф.
|
Применение
многофакторного корреляционного анализа в экспериментальной токсикологии при
изучении поведенческих реакций животных. «Гигиена и санитария», 1981, № 3).
|
|
6. Бухтияров
А.Г.
Елизарова О.Н.
|
Методика изучения
условнорефлекторной деятельности белых крыс при хроническом действии малых пороговых
количеств яда. М., НИИ санитарии и гигиены им. Ф.Ф. Эрисмана, 1960, 25 с.
|
|
7. Голубева
М.И.
Шашкина Л.Ф.
|
Влияние
андрогенов на дифференцировку половых центров и формирование полового
поведения. Д-26/38, «Мед. реф. журн.», 1980, XX, № 1 публ. 51.
|
|
8. Голубева
М.И.
Шашкина Л.Ф.
|
К методике
изучения полового поведения крыс в эксперименте. Деп. № 3053-79, «Деп. рукоп.
ВИНИТИ», 1979, № 12, б/о 136.
|
|
9. Гублер Е.В.
Генкин А.А.
|
Применение критериев
непараметрической статистики для оценки групп наблюдений в
медико-биологических исследованиях. М, 1969, 140 с.
|
|
10. Елизарова
О.Н.
|
Определение
пороговых доз промышленных ядов при пероральном введении. М., «Медицина»,
1971, 191 с.,
|
|
11. Закусов
В.В.
|
Влияние
транквилизаторов и антидепрессантов на суммацию импульсов в центральной
нервной системе. «Фармакол. и токсикол.», 1971, Т. 34, № 1 с. 7 - 9.
|
|
12.
Котляревский Л.И.
|
Методика изучения
двигательных условных рефлексов у некоторых мелких, животных. «Журн. ВИД»,
1951, т. 1. № 5, с. 753 - 76.
|
|
13. Кругликов
Р.И.
Долганов Г.М.
|
Влияние
скополамина на образование, сохранение и воспроизведение временных связей.
«Журн. ВДН» 1972, т. 22, № 4, с. 837.
|
|
14. Кругликов
Р.И,
|
О феномене напоминания.
«Журн. ВИД», 1971, т. 21, № 2, с. 419.
|
|
15. Кулагин
Д.А.
|
Исследование
эмоциональности у крыс линий Вистар и Крушинского-Молодкиной методом
«открытого поля». В кн. «Генетика поведения», Л., 1969, с. 35.
|
|
16. Медведь
Л.И.
Спыну Е.И.
Каган Ю.С.
|
Метод условных,
рефлексов в токсикологии пестицидов. В кн.: «Гигиена и токсикология
пестицидов», Киев, «Здоровья», 1966, в. 4, с. 5 - 34.
|
|
17. Павленко
С.М.
Гусева В.А.
|
Применение методов
функциональных нагрузок при нормировании химических веществ во внешней среде.
В сб. научн. трудов НИИ гигиены им. Ф. Ф. Эрисмана, М., 1975, с. 78 - 81.
|
|
18. Павленко
С.М.
Кудрин Л.В.
|
Сравнительные
экспериментальные данные изучения состояния ЦНС методом условных рефлексов и
методом суммационно-порогового показателя при гигиеническом нормировании.
«Гиг. и санитар.», 1976, № 8, с. 64 - 67.
|
|
19. Правдин
Н.С.
|
Вопросы
промышленной токсикологии. М., 1960, Медтиз, 249 с.,
|
|
20. Рылова Л.М.
|
Метод исследования
хронического действия вредных факторов среды в эксперименте. Л., 1964, 228 с.
|
|
21. Саноцкий
С.В.
|
Методы
определения токсичности и опасности химических веществ. М., «Медицина». 1970,
342 с.
|
|
22. Сперанский
С.В.
|
Определение суммационно-порогового
показателя (СПП) при различных формах токсикологического эксперимента.
Методические рекомендации, Новосибирск, 1975, 26 с.
|
|
23. Трут Л.Н.
Бородин П.М.
|
Формирование поведения
некоторых лабораторных грызунов под воздействием среды на ранних этапах
онтогенеза. «Усп. совр. биол.», 1976, т. 82, в. 1 (4) с. 143 - 155.
|
|
24. Уланова
И.П.
Саноцкий И.В.
Корсакова А.И,
|
Опыт исследования
высшей нервной деятельности при воздействии химических веществ. - Материалы
научной конф., поев, вопр. гиг. труда; пром. токсикол. и профпатол. в
нефтяной и нефтехимия, промышл., Баку, 1966, с. 79 - 80.
|
|
25. Федянина
В.Н.
Экштат Б.Н.
Павленко М.Н.
|
Сравнительная оценка
методов изучения состояния ЦНС в исследованиях по гигиеническому
нормированию. «Гиг. и санитар.», 1976, № 3, с. 67 - 72.
|
|
26. Хаунина
Р.А.
|
Влияние фенигамы
и нейролептиков на возбуждение, вызываемое холинолитическими и
симпатомиметическими средствами. «Фармакол. и токсикол.» 1969, т. XXXII, № 3,
с. 275.
|
|
27. Шишкина
Л.Ф.
Голубева М.И.
Неугодова О.П.
Федоров В.К.
|
Влияние
андрогенных препаратов на половое поведение крыс в отдаленные сроки наблюдения.
ЦБНТИ сер. «Хим. фарм, пром.» в. 7., 1977, 21 - 23.
|
|
28. Черкинский
С.Н.
Фридлянд С.А.
Каган Г.З.
|
К оценке
сравнительной чувствительности показателей состояния условнорефлексорной
деятельности в исследованиях по гигиеническому нормированию. «Гиг. и
санитар.», 1974, № 1, с. 14 - 16.
|
|
29. Цапко В.Г.
и соавт.
|
Устройство для
изучения условных рефлексов мелких лабораторных животных. Рац. предл. № 41, от
17/У-1975.
|
|
30. Bättig K.
|
Neurobiological
and behavioral toxicity in animals. - «Activ. nerv. super», 1976, 18, 4, 270
- 274.
|
|
31. Beach F.А.
|
A
review of physiological studies of sexual behavior in mammals. - «Physiol.
Rev.», 1947, 27, 240 - 307.
|
|
32. Boissier J.R.
Simon P.
|
L’utilisation
d’une reaction, particuliere de la souris (methode de la plache a trous) pour
1’etude des medicaments psychotropes - «J. Therapie», 1964, 19, 3, 571.
|
|
33. Dinman B.
|
Development
of. Workplace Enviroment Standarts in Foreign Countries. Pt. 2. - Concepts of
Higer Nervous Function in the USSR - «J. Occup. med.», 1976, 18, 7, 477 -
484.
|
|
34. Eliasson M.
Meyerson B.J.
|
Sexual
preference in femal rats during estrous cycle, pregnancy and lactation. -
«Physiol, and behav.», 1975, 14, 6, 705 - 710.
|
|
35. Gerall H.D.
Ward I.L.
|
Disruption
of the male rats sexual behaviour induced by social isolation. - «Anim.
Behav.», 1967, 15, 54 - 58.
|
|
36. Hall C.S.
|
The
method of open field. - «J. Comparative Psychology», 1934, 17, 89.
|
|
37. Hinde R.A.
(Хайнд P.)
|
Поведение
животных. M., «Мир», 1975, 855 с.
|
|
38. Horvath M.
(Хорват M)
|
Исследование
функций центральной нервной системы в токсикологическом эксперименте. - «Гиг.
труда и профзабол.», 1955, № 3, с. 9 - 16.
|
|
39. Jacobsën F.
|
Danish
Patent 11798, 1970, р. 644-K1. 42 L 13/04.
|
|
40. Pfaff D. Lewis C.
|
Film
analysis of lordosis in female rats. - «Horm. Behav.», 5, 317 - 335.
|
|
41. Weis B.
Laties V.
|
Behavioral
Toxicology. Hill Collecti of papers at the 5-th Rochester Conferense.
New-York
- London, Plenum Press, 1975, 469 pp.
|
|
42. Weis B. Levine T.
|
Studies
in the behavioral toxicology of enviromental contaminats. - «Environ. Health
Prospect», 1976, 13, 31 - 85.
|
|
43. Young W.T.
Goy R.W.
PhoeniS С.H.
|
Hormones
and sexual behaviour.-«Science»,. 1964, 143, 212 - 216.
|
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)