Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
1.2.
ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Определение приоритетных видов
наноматериалов в объектах
окружающей среды, пищевых продуктах и
живых организмах
Методические рекомендации
МР 1.2.2641-10
Москва
2010
1. Разработаны Федеральной службой по надзору в сфере защиты
прав потребителей и благополучия человека (Г.Г. Онищенко, И.В. Брагина, Т.Ю.
Завистяева); Учреждением Российской академии медицинских наук научно-исследовательский
институт питания РАМН (В.А. Тутельян, И.В. Гмошинский, С.А. Хотимченко, И.В.
Аксенов, Е.А. Арианова, В.В. Бессонов, В.М. Верников, М.М.Г. Гаппаров, Р.В.
Распопов, О.И. Передеряев, О.Н. Тананова, А.А. Шумакова, К.И. Эллер); Учреждением
Российской академии медицинских наук научно-исследовательский институт
эпидемиологии и микробиологии им. Почетного академика Н.Ф. Гамалеи РАМН (А.Л.
Гинцбург, Б.С. Народицкий, М.М. Шмаров, Д.Ю. Логунов); Государственным
учебно-научным учреждением Биологический факультет Московского государственного
университета им. М.В. Ломоносова (М.П. Кирпичников, К.В. Шайтан, А.П. Бонарцев,
А.В. Феофанов, Д.В. Багров, В.В. Воинова, А.П. Босхомджиев, А.С. Шебанова, А.С.
Китаев, М.Е. Боздаганян, О.М. Ковалева, А.А. Корчагина, Ф.С. Орехов, Е.С.
Трифонова, А.В. Честнова); Учреждением Российской Академии наук Институт
биохимии им. А.Н. Баха РАН (В.О. Попов, Б.Б. Дзантиев, А.В. Жердев);
Учреждением Российской академии наук Институт проблем экологии и эволюции им.
А.Н. Северцова РАН (Д.С. Павлов, Ю.Ю. Дгебуадзе, Е.С. Бродский, Е.Ю. Крысанов,
Т.Б. Демидова А.В. Купцов); Федеральным государственным унитарным предприятием
«Всероссийский научно-исследовательский институт метрологической службы» (ФГУП
ВНИИМС) (С.А. Кононогов, С.С. Голубев); Учреждением Российской академии наук
Центр «Биоинженерия» РАН (К.Г. Скрябин, О.А, Зейналов, Н.В. Равин, С.П.
Комбарова); ООО «Интерлаб» (А.Н. Веденин, Г.В. Казыдуб).
2. Разработаны в рамках реализации Федеральной целевой
программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на
2008-2010 годы».
3. Утверждены Руководителем Федеральной службы по надзору в
сфере защиты прав потребителей и благополучия человека, Главным государственным
санитарным врачом Российской Федерации Г.Г. Онищенко 24 мая 2010 г.
4. Введены в действие с 24 мая 2010 г.
5. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ
Руководитель
Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный
врач Российской Федерации
______________________
Г.Г. Онищенко
24 мая
2010 г.
Дата
введения: 24 мая 2010 г.
|
1.2.
ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Определение приоритетных видов наноматериалов
в объектах окружающей среды, пищевых продуктах и
живых организмах
Методические рекомендации
МР 1.2.2641-10
1.1. Настоящие методические рекомендации определяют методы
исследования содержания наночастиц и наноматериалов искусственного
происхождения в некоторых видах пищевых продуктов и компонентах биоты.
1.2. Настоящие методические рекомендации применяются в целях
принятия решений по оценке рисков, связанных с процессами производства и
оборота наноматериалов.
1.3. Методические рекомендации разработаны с целью
обеспечения единства измерений при анализе наноматериалов искусственного
происхождения на всех стадиях их жизненного цикла.
1.4. Методические рекомендации предназначены для
специалистов органов Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека, научно-исследовательских организаций
гигиенического профиля и медицинских учебных заведений, а также иных
организаций и учреждений, занимающихся вопросами определения приоритетных
наночастиц и наноматериалов.
Использование нанотехнологий и наноматериалов является одним
из самых перспективных направлений науки и техники в XXI веке. Особенности
поведения вещества в виде наночастиц, свойства которых во многом определяются
законами квантовой физики, открывают широкие перспективы в целенаправленном
получении материалов с новыми свойствами, такими как уникальная механическая прочность,
особые спектральные, электрические, магнитные, химические, биологические
характеристики.
В ближайшей перспективе следует ожидать резкого увеличения
объёмов производства во всём мире ряда приоритетных наноматериалов, в частности
таких, как наночастицы оксидов кремния, титана, цинка, железа, церия, алюминия,
металлические наночастицы железа, меди, кобальта, никеля, алюминия, серебра,
золота, углеродные нанотрубки, фуллерены, наночастицы биополимеров и
рекомбинантных вирусов. Это с неизбежностью приведёт к поступлению значительных
количеств наноматериалов в окружающую среду, их накоплению в компонентах биоты
и абиотических средах с последующей передачей человеку.
Это делает необходимой разработку государственной системы
контроля и надзора за производством нанотехнологической продукции, составной
частью которой является мониторинг наличия приоритетных видов наноматериалов в
объектах окружающей среды, компонентах биоты, сельскохозяйственных растениях и
животных, пищевых продуктах.
Настоящие методические рекомендации разработаны в рамках
реализации Федеральной целевой программы «Развитие инфраструктуры наноиндустрии
в Российской Федерации на 2008 - 2010 гг.» в целях установления единого, научно
обоснованного подхода к выявлению и количественному определению наиболее важных
видов наноматериалов в природных биологических и абиотических объектах, включая
некоторые виды пищевых продуктов.
3.1. Проведение исследований по выявлению и количественному
определению наноматериалов определяются правилами надлежащей лабораторной
практики.
3.2. Требования к стандартным наноматериалам.
3.2.1. Для верификации, стандартизации и калибровки методов,
применяемых при определении наноматериалов, используются стандартные образцы
наноматериалов (стандарты).
3.2.2. Каждый стандарт наноматериала должен быть
охарактеризован на соответствие государственному эталонному образцу по
показателям химического состава (включая наличие примесей), размеру и форме
частиц, удельной площади поверхности, типу кристаллической структуры. Указанные
характеристики определяются с использованием методов масс-спектрометрии с
индуктивно связанной плазмой, трансмиссионной электронной микроскопии,
определения изотерм адсорбции инертных газов, рентгенофазового
(рентгенодифракционного) анализа. В случае стандартных образцов фуллеренов при
проверке соответствия используется метод обращённофазовой ВЭЖХ.
3.2.3. Каждый стандартный образец наноматериала должен быть
снабжён «Паспортом безопасности наноматериалов», который составляется в
соответствии с ГОСТ
30333-95 «Паспорт безопасности вещества (материала)».
3.2.4. Стандартные образцы наноматериалов должны иметь
упаковку для защиты при транспортировке от загрязнения или порчи.
3.2.5. Хранение стандартных образцов наноматериалов
осуществляется отдельно от остальных применяемых веществ с соблюдением условий
хранения, указанных в паспорте безопасности, на протяжении всего срока годности
образца.
3.2.6. Хранение и использование стандартных образцов
наноматериалов осуществляется в соответствии с утвержденным протоколом исследования.
3.3. Требования к используемому оборудованию.
3.3.1. Организации, проводящие определение наноматериалов
должны быть оснащены необходимым оборудованием, прошедшим метрологический
контроль в установленном порядке.
3.3.2. Эксплуатация оборудования проводится в соответствии с
техническим паспортом и инструкцией по применению. Результаты проведения
калибровки и текущего ремонта оборудования фиксируются в специальном журнале,
доступном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим
его обслуживание.
3.4. Планирование и проведение исследований.
3.4.1. Определение наноматериалов проводится по
утвержденному плану с ведением протокола и составлением отчета, в который
заносятся все результаты исследований.
3.4.2. Результаты определения наноматериалов заносятся в
протокол, в котором отражены цели работы и методы, используемые для достижения
этих целей. Протокол исследования утверждается руководителем организации,
проводящей исследования, и включает: цель и задачи исследования, имеющиеся
сведения об определяемом наноматериале (физические, химические, биологические,
токсикологические свойства), используемые стандартные образцы, схему
исследования и её обоснование, методы отбора проб природных объектов, методы
исследования, результаты исследований, метрологическую характеристику анализа,
статистическую обработку результатов исследования, заключение.
Вносимые в протокол исследования изменения, а также
отклонения от протокола (незапланированные события, непредвиденные
обстоятельства и т.д.) записываются и подписываются исполнителем, датируются в
приложении с указанием причин и утверждаются руководителем исследования.
3.5. Требования к оформлению отчета.
3.5.1. По окончании проведенных определений оформляется
отчет, в котором представляются: название; адрес организации; даты начала и
завершения исследований; цель и задачи исследования; характеристика
определяемого наноматериала; перечень исследованных образцов и применяемых
стандартов; схема проведения исследования; описание методов статистической
обработки результатов; результаты исследования, представленные в виде
обобщающих таблиц, рисунков с соответствующей статистической обработкой и
комментариев к ним; заключение.
3.5.2. Отчет о результатах проведенного исследования
составляется ответственным исполнителем, утверждается руководителем организации
и скрепляется печатью организации.
3.6. Система обеспечения качества исследований.
3.6.1. Контроль за качеством проведения исследований
включает в себя оформление перечня исследований, проводимых в организации, с
указанием для каждого исследования руководителя и заказчика, названия
определяемого наноматериала, даты начала и состояния каждого исследования на
текущий момент времени, оценку протоколов и методов исследования на
соответствие правилам лабораторной практики, мониторинг текущих исследований,
отчет о проведенных проверках и рекомендации по устранению недостатков.
3.6.2. Для осуществления контроля качества руководство
организации назначает, в соответствии с правилами надлежащей лабораторной практики,
ответственных лиц за мониторинг исследования из числа сотрудников, не
участвующих в исследовании.
3.7. Стандартные операционные процедуры.
3.7.1. Стандартные операционные процедуры разрабатываются на
все производственные операции, включая: поступление, идентификацию, маркировку,
отбор образцов, обработку проб, использование и хранение исследуемых проб,
хранение и аттестацию стандартов; обслуживание и калибровку измерительных
приборов и оборудования; приготовление реактивов, ведение записей, отчетов и их
хранение; обслуживание помещений; обезвреживание или утилизация наноматериалов
и содержащих их образцов (если это необходимо); осуществление программы по
обеспечению качества.
3.7.2. Соблюдение стандартных операционных процедур
осуществляется в целях обеспечения качества, достоверности и воспроизводимости
результатов исследования.
3.7.3. Отклонения от стандартных операционных процедур
должны быть документально оформлены и утверждены руководителем исследования.
3.7.4. Организация, проводящая настоящие исследования,
должна иметь утвержденный порядок приема и учета поступления анализируемых проб
и стандартов наноматериалов; проводить учет анализируемых проб и стандартов
наноматериалов при поступлении, расходовании, возврате заказчику или их
утилизации; принимать меры по обеспечению идентификации исследуемых образцов
(название, химическая формула - при наличии) и их стабильности на протяжении
всего исследования. Для образцов наноматериалов на этикетке дополнительно
должны указываться степень дисперсности, размер, форма частиц, при
необходимости - удельная площадь поверхности и кристаллическая структура.
3.8. Меры конфиденциальности.
3.8.1. Сотрудники, принимающие участие в проведении
исследований, обязаны соблюдать конфиденциальность в отношении любых данных, полученных
в ходе исследования, в соответствии с законодательством Российской Федерации.
3.8.2. Организация, проводящая исследования, должна
обеспечить конфиденциальность результатов исследований в рамках принятых ею
обязательств и в соответствии с законодательством Российской Федерации.
Исходя из ситуации с производством и использованием
наночастиц и наноматериалов, а также имеющихся сведений о факторах риска,
связанных с наночастицами, при выборе приоритетных видов наноматериалов по
содержанию в природных биологических и абиотических объектах и пищевых
продуктах следует руководствоваться следующими принципами:
- в наборе анализируемых наночастиц должны присутствовать представители
основных групп;
- анализируемые наночастицы производятся или в ближайшее
время будут производиться в больших объемах;
- наночастицы могут оказывать воздействие на организм;
- наночастицы должны быть «стандартными», т.е. хорошо
охарактеризованными и однородными по размеру, составу и форме.
Стандартные образцы наноматериалов классифицируются в
соответствии с их химическим составом. За основу принята классификация,
используемая в международном реестре наночастиц и наноматериалов:
- металлические наночастицы (Au, Ag, Pt, Pd, Ru, Ni, Cu и другие);
- наночастицы оксидов металлов и неметаллов (SiO2, Аl2O3, ТiO2, SnO2, ZnO, МоO3)
V2O5, PbO, Fe2O3, NiO и другие);
- полупроводниковые наночастицы (CdS, CdSe, PbS, PbTe, GaN,
GaAs, InN и другие);
- углеродные наночастицы (фуллерены С60,
углеродные нанотрубки и некоторые другие);
- наночастицы органически модифицированных слоистых
силикатов и алюмосиликатов (наноглины различного состава);
- наночастицы из органических разветвленных полимеров
(дендримеры различного состава).
Далее приведены краткие характеристики некоторых видов
промышленно выпускаемых наноматериалов, для которых характерны наибольшие
объёмы производства и, следовательно, наибольшая вероятность выявления в
составе объектов природной среды.
4.1. Фуллерены - наночастицы, образованные определённым
(обычно 60 или 70) числом атомов углерода, организованных в сферический каркас.
Фуллерены можно рассматривать как отдельную аллотропическую форму углерода, не
тождественную двум ранее известным - алмазу и графиту. Форма выпуска
фуллеренов: порошки или растворы в органических растворителях, а также
нанопленки (толщиной до 20 нм). В эту группу входят и химически
модифицированные фуллерены: гидроксилированные, галогенированные, связанные с
аминокислотами и металлами. Немодифицированные фуллерены практически
нерастворимы в воде и полярных растворителях, а также в алифатических
углеводородах и жирах; умеренно растворимы в ароматических углеводородах
(толуол, ксилол, хлорбензол). Возможно получение коллоидных (мицеллярных)
водных растворов фуллеренов в комплексе с некоторыми поверхностно-активными
веществами и полимерами. Многие химически модифицированные фуллерены хорошо
растворимы в воде. Истинные (молекулярные) растворы фуллеренов окрашены (имеют
красный или фиолетовый цвет), имеют характеристический максимумом поглощения в
ближнем ультрафиолете при длине волны 324 - 340 нм.
Контаминация природных биологических и абиотических объектов
фуллеренами возможна в ходе их производства, перевозки фуллеренсодержащей продукции
и утилизации её отходов.
4.2. Углеродные нанотрубки по структуре близки к фуллеренам,
но представляют собой не сферические, а линейные (протяженные) каркасные
конструкции, сложенные атомами углерода. Различают однослойные (одностенные) и
многослойные (многостенные) нанотрубки. Последние представляют из себя
конструкции из коаксиально вложенных одна в другую однослойных нанотрубок
разного диаметра. Другим показателем структуры нанотрубок является
спиральность, то есть величина атомарного сдвига, достигаемого при замыкании
плоского слоя, образованного атомами углерода, в трубку. В промышленных
условиях производятся нанотрубки различного диаметра (от 1 до 90 нм) и
различной степени очистки в виде порошков, суспензий в органических
растворителях, в отдельных случаях в виде гелей или пленок. Нанотрубки, как и
фуллерены, практически нерастворимы в воде и полярных растворителях, однако они
обладают липофильностью и способны накапливаться в организме. По условиям
своего получения одностенные углеродные трубки практически всегда содержат
примесь металлических катализаторов (как правило, переходных металлов VIII
группы или меди).
4.3. Наночастицы металлического серебра имеют форму, близкую
к сферической, и размер, в зависимости от условий получения, от 5 до 80 нм.
Различные препараты наносеребра имеют разную степень гетерогенности по размерам
частиц. Препараты наночастиц серебра нестабильны и проявляют выраженную
склонность к агрегации с образованием комплексов значительно большего, чем
исходные частицы, размера. Стабильные дисперсии наночастиц серебра в воде или в
органических растворителях (гексан, бензол и т.д.) могут быть получены в
присутствии анионактивных поверхностно-активных веществ или полимеров,
например, поливинилпирролидона. Они представляют собой жидкости, окрашенные (в
зависимости от концентрации наночастиц) в жёлтый или коричневый цвет.
4.4. Наночастицы диоксида титана выпускаются в двух основных
видах, различающихся по своей кристаллической структуре: анатаза - представлена
наночастицами формы, близкой к сферической, и размером в диапазоне 5 - 15 нм;
рутил - представлен наночастицами в форме палочек или стержней диаметром около
10 и длиной до 40 нм. Обе изоформы наноразмерного диоксида титана в чистом виде
представляют собой лёгкие белые порошки, которые интенсивно электризуются. Они
не растворимы в воде, но легко диспергируются в воде с образованием жидкостей
молочно-белого цвета, которые затем медленно (на протяжении часов)
седиментируют. В среде биологических жидкостей различного состава наночастицы
диоксида титана агрегируют с образованием комплексов субмикронного размера.
4.5. Наночастицы диоксида кремния представлены двумя
модификациями: аморфной (кремнезем) и кристаллической (кварц). Форма частиц
близка к сферической, размер, в зависимости от условий получения, варьирует от
5 до 80 нм. Внешний вид наноматериала - лёгкие порошки белого цвета.
Наночастицы аморфного кремнезема обладают различной степенью пористости,
поэтому данные оценки их удельной площади поверхности на основании геометрии
частиц и по методу изотерм адсорбции инертных газов могут сильно расходиться. В
среде биологических жидкостей различного состава наночастицы диоксида кремния,
так же, как и диоксида титана, агрегируют с образованием комплексов
субмикронного размера.
4.6. Наночастицы оксида алюминия имеют сферическую форму и
размер в диапазоне, как правило, 30 - 60 нм. В форме нанопорошков они
стабильны, в воде и биологических жидкостях проявляют склонность к агрегации.
По своему агрегатному состоянию представляют собой лёгкие порошки белого цвета,
нерастворимые в воде и органических растворителях, но растворимые в
разбавленных кислотах и щелочах.
4.7. Наночастицы оксида цинка имеют форму близкую к
сферической и размер в диапазоне 10 - 100 нм. Они представляют собой лёгкий
порошок белого цвета, не растворимый в воде и органических растворителях, но
легко растворимый в разбавленных кислотах и щелочах.
5.1. Электронная микроскопия
Для подтверждения присутствия в биопробах определяемых
наноматериалов в форме наночастиц, определения их размера, формы и локализации
используется электронная микроскопия. Для наночастиц, максимальный размер
которых менее 5 нм, их форма не описывается. Приведенный метод определения
наночастиц предназначен для определения частиц металлов и оксидов металлов.
5.1.1.
Принцип метода
В основе метода просвечивающей электронной микроскопии (ПЭМ)
лежит упругое рассеяние пучка электронов при взаимодействии с исследуемым
объектом. Изображение формируется потоком рассеянных электронов с энергией 50 -
200 кэВ, прошедших через находящийся на подложке образец, и при помощи системы
магнитных линз проецируется на матрицу ПЗС-камеры.
Для идентификации наночастиц используются аналитические
методики ПЭМ - дифракция электронов с выбранной области, спектроскопия
характеристических потерь энергии электронов (СХПЭЭ) и измерение изображений в
диапазоне характеристических потерь энергии электронов на анализируемом
элементе.
В режиме дифракции электронов результатом измерений является
электронограмма, содержащая отдельные рефлексы в случае монокристаллического
образца или концентрические кольца в случае поликристаллического образца.
Идентификация аморфных наночастиц с помощью дифракции электронов невозможна.
Методика СХПЭЭ может использоваться на ПЭМ, снабжённых
системой фильтрации электронов по энергии, и позволяет идентифицировать
элементный состав частиц, вплоть до единичных частиц, найденных на образце в
режиме регистрации изображения. Электроны, прошедшие через образец, делятся на
два типа: первая группа - упруго рассеянные и прошедшие сквозь образец
электроны, не испытавшие каких-либо энергетических потерь, вторая группа -
неупруго рассеянные электроны, испытавшие потери энергии в результате
взаимодействия с образцом. В методике СХПЭЭ анализируется энергетический спектр
неупруго рассеянных электронов. Результатом измерения является график, на
котором вдоль оси х отложены значения энергий, по оси у -
интенсивность сигнала (зависящая от количества электронов, испытавших потери
энергии). Пики в спектре потерь энергии, которые обычно называют краями
поглощения, различаются для разных материалов и зависят от строения электронных
оболочек атомов образца.
Математически спектр характеристических
потерь с выбранной точки описывается соотношением:
I(α,
Δ) - интенсивность сигнала, зарегистрированного
приемником (например, CCD-камерой) при выбранном диапазоне энергий (ΔЕ -
Δ/2; ΔЕ + Δ/2) и углах рассеяния от 0 до α;
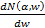 - это количество электронов,
приходящееся на интервал потерь энергии 1 эВ, которые за 1 с рассеиваются на
углы от 0 до α. Величина ΔЕ задает середину интервала, в котором
снимается спектр;
- это количество электронов,
приходящееся на интервал потерь энергии 1 эВ, которые за 1 с рассеиваются на
углы от 0 до α. Величина ΔЕ задает середину интервала, в котором
снимается спектр;
с - коэффициент усиления электронной системы прибора;
е - заряд электрона.
На микроскопах, оснащённых системой фильтрации электронов по
энергии, помимо режима снятия спектров ХПЭЭ с выбранной области, возможен также
режим пространственно-разрешённой СХПЭЭ, или элементное картирование. Конечным
результатом эксперимента по картированию некоторого выбранного элемента
является дискретное изображение, на котором интенсивность цвета каждой точки
пропорциональна концентрации этого элемента.
Каждый элемент имеет максимум на спектре характеристических
потерь, соответствующий энергии некоторой электронной оболочки (эти значения
табулированы и обычно указаны в программном обеспечении, поставляемом с
электронным микроскопом). Для того, чтобы провести элементное картирование, с
выбранной анализируемой области снимаются три изображения: два формируются
электронами, имеющих энергии, отличные от максимума поглощения (ΔEW1
- Δ/2; ΔEW1 + Δ/2) и (ΔEW2
- Δ/2; ΔEW2 + Δ/2), а третье
изображение формируется электронами, имеющими энергию, близкую к максимуму
поглощения (ΔEWmax -
Δ/2; ΔEWmax + Δ/2). Первые
два изображения используются для того, чтобы сформировать фоновое изображение и
вычесть фон из изображения, полученного в диапазоне энергий (ΔEWmax - Δ/2; ΔEWmax
+ Δ/2). Таким образом, суть элементного картирования заключается в
получении изображений на характеристических энергиях искомого элемента.
В единичных случаях фон может быть построен, исходя из
единственного изображения (ΔEW1 - Δ/2; ΔEW1 + Δ/2), однако для большей универсальности
рекомендуется строить фон по двум изображениям, т.е. использовать трехоконную
методику. Ширина окна А обычно выбирается 10 - 15 эВ.
5.1.2.
Приборы и оборудование
5.1.2.1. Средства измерения.
Просвечивающий электронный микроскоп с компьютерным управлением
со следующими параметрами:
- диапазон величин ускоряющего напряжения электронов не
меньше 80 - 100 кВ;
- диапазон увеличений в режиме ПЭМ 10000 - 200000;
- система фильтрации электронов по энергии и параллельная
детектирующая система спектров ХПЭЭ с разрешением по энергии не хуже 2 эВ и
областью измерения энергий электронов в диапазоне не менее 0 - 2500 эВ;
- возможность работы в режиме дифракции параллельного пучка
электронов;
- наличие полевой апертурной диафрагмы диаметром 1 мкм или
меньше;
- предельное пространственное разрешение не хуже 0,5 нм.
Система фильтрации электронов по энергии может быть как
внутриколонная, так и постколонная. Рекомендуется использовать микроскопы с
ПЗС-камерой в качестве системы регистрации изображений, т.к. результаты сразу
же получаются в цифровом виде.
Для удобства оператора желательно наличие в составе
микроскопа телевизионной камеры, транслирующей изображение с люминесцентного
экрана на экран монитора.
Не реже одного раза в месяц или непосредственно перед измерениями
проверяется правильность настройки микроскопа, включая следующие параметры:
разрешающая способность микроскопа, коррекция астигматизма, калибровка масштаба
изображения на ПЗС-камере при различных коэффициентах увеличения (в первую
очередь в рабочем диапазоне увеличений). Выбираются ускоряющее напряжение и
параметры линз объектива, при которых будут проводиться измерения дифракции
электронов, и при этих параметрах определяется (проверяется) эффективная длина
камеры (расстояние между образцом и ПЗС-матрицей). Для проверки перечисленных
параметров используются соответствующие стандартные образцы.
Разрешающая способность проверяется путем получения
изображений от кристаллов, в которых должны быть видны (разрешены) плоскости
кристаллической решетки. В зависимости от предельной разрешающей способности
микроскопа в качестве стандартных могут быть использованы следующие образцы:
кристаллы асбеста (межплоскостные расстояния 0,903 и 0,452 нм), кристаллы
фталоцианина меди (межплоскостные расстояния 1,03 нм), графитизированный
углерод (межплоскостные расстояния 0,34 нм), ориентированные кристаллы золота
(межплоскостные расстояния 0,204, 0,143 и 0,102 нм).
Коррекция астигматизма проверяется с помощью образца, в
котором присутствуют неоднородности с четкими краями (стандартный образец -
углеродная пленка с дырочками), по симметричности (должны быть симметричны)
полос Френеля, формирующихся на краях неоднородностей (на краях дырочек в
углеродной пленке), при фокусировке и дефокусировке изображения (выполняется
путем дефокусировки линз объектива).
Для калибровки масштаба изображения используется стандартный
образец с регулярными неоднородностями, расстояние между которыми известно
(например, реплики дифракционных решеток с известным расстоянием между
штрихами).
Для измерения длины камеры (расстояния между образцом и
ПЗС-матрицей) применяется стандартный поликристаллический образец, для которого
известны межплоскостные расстояния кристаллической решетки.
Внеочередная проверка настройки микроскопа проводится, если
в процессе измерений выявляются артефакты, которые, по мнению оператора, могут
быть связаны с разъюстировкой микроскопа. Если очередная или внеочередная
проверка выявила существенную разъюстировку микроскопа по одному или нескольким
из перечисленных выше параметров, то определение наночастиц в образцах
проводиться не может до устранения неисправности.
Электронный микроскоп может применяться для определения
наночастиц в биологических объектах (пробах), если при проверке правильности
настройки микроскопа получены следующие результаты:
- тест на разрешающую способность подтверждает, что
разрешение микроскопа не хуже 0,5 нм;
- удалось добиться эффективной коррекции астигматизма;
- масштаб изображений откалиброван с точностью до 5 %;
- измерена длина камеры (расстояние между образцом и
ПЗС-матрицей) и определены ускоряющее напряжение и параметры линз объектива,
при которых будут проводиться измерения дифракции электронов в исследуемых
образцах.
5.1.2.2. Вспомогательное
оборудование.
|
Гомогенизатор - аппарат для измельчения
животных тканей и клеток и превращения их в гомогенат. Подходит любой
гомогенизатор (ручной Даунса, ручной Поттера Эльвейема, электромеханический,
ультразвуковой), который может работать с небольшими количествами (100 - 300
мг) гомогенизируемых тканей
|
|
|
Ультрамикротом, обеспечивающий
нарезку срезов для электронной микроскопии толщиной от 30 до 300 нм с
точностью не хуже 10 %
|
|
|
Вакуумная система для напыления
углеродных пленок
|
|
|
Весы лабораторные аналитические
|
ГОСТ
24104-2001
|
|
Электрошкаф сушильный лабораторный
с погрешностью поддержания температуры ±2,5 °С в интервале от 50 до 350 °С
|
ТУ 16-531.639
|
|
Холодильник бытовой
|
ГОСТ
16317-87
|
|
pH-метр
|
ГОСТ
27987-88
|
|
Колбы плоскодонные конические на
250 см3 с НШ 29, тип КнКШ 250-29/32
|
ГОСТ
25336-82
|
|
Колбы мерные вместимостью 100,
500, 1000 см3 тип 2-100-2, 2-500-2
|
ГОСТ
1770-74
|
|
Воронки лабораторные
|
ГОСТ
25336-82
|
|
Флаконы стеклянные завинчивающиеся
из темного стекла (вайл) объемом 10 см3
|
|
5.1.3.
Реактивы и материалы
5.1.3.1. Реактивы.
|
Хлорид натрия, хч
|
ГОСТ
4233-77
|
|
Фосфат калия однозамещенный,
квалификации, хч
|
ГОСТ
4198-75
|
|
Фосфат калия двузамещенный
трехводный, квалификации хч
|
ГОСТ
2493-75
|
|
Дистиллированная вода
|
ГОСТ 6709-79
|
|
Четырехокись осмия (OsO4) фирмы
«Sigma-Aldrich» (США) или аналогичная
|
|
|
Спирт этиловый абсолютированный
(содержание - 99,8 % по объему)
|
ТУ 6-09-5100-83
|
|
Спирт этиловый ректифицированный,
96 % ГОСТ
Р 51652-2000
|
Стр. 16
|
|
Уранилацетат фирмы «Sigma-Aldrich»
(США) или аналогичный
|
|
|
Цитрат свинца фирмы
«Sigma-Aldrich» (США) или аналогичный
|
|
|
Нитрат свинца фирмы «Sigma-Aldrich»
(США) или аналогичный
|
|
|
Цитрат натрия фирмы
«Sigma-Aldrich» (США) или аналогичный
|
|
|
Гидроксид натрия (NaOH), хч
|
ГОСТ 4328-77
|
|
Ацетон, чда
|
ГОСТ 2603-79
|
|
Эпон 812 (Epoxy Embedding Medium)
фирмы «Sigma-Aldrich» (США) или аналогичный
|
|
|
Додецил янтарный ангидрид фирмы «Sigma-Aldrich»
(США) или аналогичный
|
|
|
Метилэндиковый ангидрид МЭА-610
фирмы «Sigma-Aldrich» (США)
или аналогичный
|
|
|
Тридиметиламинофенол (катализатор DMP-30) фирмы «Sigma-Aldrich» (США) или аналогичный
|
|
|
Додецилсульфат натрия, хч
|
ТУ 6-09-64-75
|
|
Протеиназа К, удельная активность
> 30,0 ед./мг, фирмы «Sigma-Aldrich»
(США) или аналогичная
|
|
|
Глутаровый альдегид
|
ТУ 6-02-1273-89
|
|
Нейтральный формалин
|
ГОСТ 1625-89
|
|
Толуидиновый синий фирмы «Sigma-Aldrich» (США) или
аналогичный
|
|
|
Формвар (Formvar® solution) фирмы «Sigma-Aldrich»
(США) или аналогичный
|
|
|
Эпон 812 (Epoxy Embedding Medium)
фирмы «Sigma-Aldrich» (США) или аналогичный
|
|
|
Додецил янтарный ангидрид фирмы
«Sigma-Aldrich» (США) или аналогичный
|
|
|
Метилэндиковый ангидрид МЭА-610
фирмы «Sigma-Aldrich» (США)
или аналогичный
|
|
|
Кислота соляная, НСl, хч
|
ГОСТ
3118-77
|
|
Кислота серная, H2SO4, хч
|
ГОСТ
4204-77
|
|
Кислота азотная, HNO3, хч
|
ГОСТ
4461-77
|
|
Дихлорэтан
|
ГОСТ
1942-86
|
|
Протеаза «Флавозим» фирмы
«Novozymes»
|
|
|
(Дания) или аналогичная
|
|
|
Кислота соляная, НСl, хч
|
|
5.1.3.2. Материалы.
|
Специальные тефлоновые платы с
лунками для заливки фирмы «Ted Pella, Inc.» (США) или аналогичные
|
|
|
Лобзик фирмы «Ted
Pella, Inc.» (США) или аналогичный
|
|
|
Специальный держатель для блоков фирмы
«Ted Pella, Inc.» (США) или аналогичный
|
|
|
Бритва фирмы «Ted
Pella, Inc.» (США) или аналогичная
|
|
|
Чашки Петри
|
ГОСТ
25336-82
|
|
Бленды, покрытые формваровой
пленкой фирмы «Ted Pella, Inc.» (США) или аналогичные
|
|
|
Бумажный фильтр типа Whatman или
аналогичный
|
ТУ 03-11-03
|
|
Медные сеточки с предварительно
нанесённой формваровой плёнкой или с напыленным тонким слоем углерода фирмы
«Ted Pella, Inc.»(США) или аналогичные
|
|
|
Одноразовые пластиковые пробирки
|
ТУ 64-2-30-80
|
|
Дозаторы пипеточные с диапазоном
объема доз 20 - 200 мм3, 200 - 1000 мм3 и дискретности
установки доз 5 мм3 с наконечниками
|
ТУ 64-16-55-90
|
|
Ножницы
|
ГОСТ 1239-93
|
|
Пинцет
|
ГОСТ
21241-89
|
|
Скальпель
|
ГОСТ
21240-89
|
|
Посуда мерная лабораторная
|
ГОСТ
1770-74
|
|
Посуда лабораторная стеклянная
|
ГОСТ
25336-82
|
5.1.3.3. Приготовление растворов.
5.1.3.3.1. Приготовление двукратного
раствора фосфорно-солевого буфера (0,2 М) 0,04 М K2НРO4,0,16 М K2НРO4, pH 7,2 - 7,4,1,76 % (w/v) KCl.
Для приготовления раствора на лабораторных весах готовят
навески 6,2 г K2НРO4×Н2O, 33,64 г K2НРO4×2Н2O и
17,4 г KCl и вносят их в мерную колбу объемом 1000 см3,
содержащую 500 см3 дистиллированной воды. Соли растворяют при
перемешивании и объем раствора доводят до 1000 см3.
5.1.3.3.2. Приготовление однократного раствора
фосфатно-солевого буфера: 0,02 М K2НРO4, 0,08 М K2НРO4, pH 7,2 - 7,4, 0,88 % (w/v) KCl.
Для приготовления 100 см3 однократного раствора
фосфатно-солевого буфера (0,1 М) к 50 см3 двукратного раствора
фосфатно-солевого буфера добавляют 50 см3 дистиллированной воды.
5.1.3.3.3. Приготовление раствора гидроксида натрия, 10 М,
pH 14.
Для приготовления 100 см3 10 М раствора
гидроксида натрия в стеклянный стакан, содержащий 50 см3
дистиллированной воды, вносят 40 г гидроксида натрия. Гидроксид натрия
растворяют при перемешивании. После его полного растворения объём раствора
доводят до 100 см3 дистиллированной водой.
5.1.3.3.4. Приготовление раствора гидроксида натрия, 1 М, pH
14.
Для приготовления 100 см3 1 М раствора гидроксида
натрия к 10 см3 10 М раствора гидроксида натрия добавляют 90 см3
дистиллированной воды.
5.1.3.3.5. Приготовление раствора для фиксации: 2,5 % (v/v)
глутаровый альдегид, 2 % (v/v) формалин, на фосфатно-солевом буфере, pH 6,9.
Для приготовления 100 см3 раствора в мерную колбу
вносят 50 см3 двухкратного раствора фосфатно-солевого буфера (по п. 5.1.3.3.1), 10 см3
коммерческого препарата глутарового альдегида (25 % водный раствор) и 5 см3
коммерческого препарата формалина (40 % водный раствор). На pH-метре доводят pH
буфера до 6,9 добавлением 1 М HCl и далее доводят объём
раствора до 100 см3 дистиллированной водой.
5.1.3.3.6. Приготовление 2 %-го (w/v)
водного раствора четырёхокиси осмия.
Для приготовления 100 см3 раствора 2 г OsO4 вносят в мерную колбу, содержащую 70 - 80 см3
дистиллированной воды. Перемешивают до полного растворения OsO4,
затем объём раствора доводят до 100 см3 дистиллированной водой.
5.1.3.3.7. Приготовление 1 %-го (w/v) четырёхокиси осмия на
фосфатно-солевом буфере.
Готовят непосредственно перед использованием! Для
приготовления 100 см3 раствора в мерную колбу вносят 50 см3
2 %-го водного раствора OsO4 (по п. 5.1.3.3.6) и 50 см3
двукратного раствора фосфатно-солевого буфера (по п. 5.1.3.3.1).
5.1.3.3.8. Приготовление 50 %-го раствора этилового спирта.
В мерную колбу объемом 1000 см3, содержащую 479
см3 дистиллированной воды, вносят 521 см3 96 %-го
этилового спирта.
5.1.3.3.9. Приготовление 60 %-го раствора этилового спирта.
В мерную колбу объемом 1000 м3, содержащую 375 м3
дистиллированной воды, вносят 625 м3 96 %-го этилового спирта.
5.1.3.3.10. Приготовление 70 %-го раствора этилового спирта.
В мерную колбу объемом 1000 см3, содержащую 271
см3 дистиллированной воды, вносят 729 см3 96 %-го
этилового спирта.
5.1.3.3.11. Приготовление 80 %-го раствора этилового спирта.
В мерную колбу объемом 1000 см3, содержащую 167
см3 дистиллированной воды, вносят 833 см3 96%-го
этилового спирта.
5.1.3.3.12. Приготовление 0,3 %-го раствора формвара в
дихлорэтане.
Для приготовления 10 см3 раствора 30 мг формвара
помещают в мерную колбу с притёртой крышкой. Туда же вносят 10 см3
дихлорэтана (градация хч). Полное растворение достигается за 3 дня. Раствор
хранят в темноте.
5.1.3.3.13. Приготовление 2 %-го раствора уранилацетата на
70 %-м этиловом спирте.
Для приготовления 10 см3 раствора 200 мг
уранилацетата растворяют в 10 см3 70 %-го этанола.
5.1.3.3.14. Приготовление раствора цитрата свинца.
Для приготовления 50 см3 раствора цитрата свинца
в мерную колбу на 50 см3 с притёртой пробкой вносят 30 см3
дистиллированной воды, 1,33 г нитрата свинца (Pb(NO3)2)
и 1,76 г цитрата натрия (Na3C6H5O7). Полностью весь нитрат свинца переходит в
цитрат свинца в течение 30 мин при периодическом встряхивании раствора. После
30-минутной инкубации к раствору добавляют 8 см3 1 N раствора
гидроксида натрия. Объём раствора доводят до 50 см3 дистиллированной
водой. Раствор тщательно перемешивают. Величина pH готового раствора должна
быть в пределах 12 ± 1. Раствор можно хранить до 6 месяцев.
5.1.3.3.15. Приготовление 0,1 %-го (w/v) водного раствора
толуидинового синего.
Для приготовления 10 см3 раствора 10 мг
толуидинового синего растворяют в 10 см3 дистиллированной воды.
5.1.4.
Стандартные образцы наноматериалов,
применяемые при калибровке метода
В качестве образцов сравнения используются стандартные наноматериалы,
которые предполагается обнаружить в биопробах.
Образец сравнения подвергается анализу методами электронной
микроскопии на том же самом приборе, на котором осуществляется исследование
образцов. Для образца сравнения методом просвечивающей электронной микроскопии
должно быть получено распределение по размерам и описана форма наночастиц.
Анализ проводится и данные представляются, как описано в п.п. 5.1.5 - 5.1.8 настоящих методических рекомендаций.
Для наночастиц, в состав которых входят легкие элементы,
должны быть получены спектры ХПЭЭ. Спектры ХПЭЭ следует снимать как с одиночных
частиц, так и с групп наночастиц. Если в образце имеет место широкое
распределение частиц по размерам, то спектры ХПЭЭ регистрируются от наночастиц
разного размера. Следует учитывать, что спектры ХПЭЭ зависят от толщины области
образца, с которой снимается сигнал, и разрешение двух пиков в спектре может
быть хуже в случае снятия спектра с группы частиц, по сравнению с отдельными
наночастицами. К спектру должны прикладываться параметры, с которыми он был
снят - угол освещённости образца, время накопления сигнала и количество циклов
записи сигнала.
Для наночастиц, в состав которых входят тяжелые элементы,
должна быть получена эталонная картина дифракции электронов в форме
концентрических окружностей. К такой эталонной картине должны прилагаться
параметры, при которых она была снята, а именно ускоряющее напряжение, эффективное
расстояние до экрана, размер апертурной диафрагмы.
5.1.5. Отбор проб и методы подготовки образцов
5.1.5.1. Отбор проб.
Отбор проб осуществляется в соответствии с действующими
нормативными документами на отдельные виды продукции.
5.1.5.2. Методы отбора проб и подготовки образцов для
организмов теплокровных животных для экспериментальных исследований.
5.1.5.2.1. Выбор вида животных.
Для определения содержания наноматериалов в организмах
животных используют различные виды лабораторных животных в соответствии с МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
В зависимости от целей исследований могут использоваться
также лемминги Lemmus sibiricus, Dicrostonyx torquatus, Myopus schisticolor;
полевки Microtus arvalis, Microtus argestis, Arvicola oeconomus; крыса
чёрная Rattus rattus; бурозубки Sorex auraneus, Sorex polustris,
Sorex jacksoni; кролики, морские свинки, а также, в случае необходимости,
крупные млекопитающие (копытные).
Для определения содержания наноматериалов в организмах
лабораторных животных рекомендуется использовать мелких лабораторных грызунов,
например, крыс линий Wistar, Sprage-Dawley или мышей Balb, CD1, СВА и др.
Исследования проводятся на здоровых животных. Требования к
лабораторным животным, условиям их содержания, кормления установлены в МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
5.1.5.2.2. Методы подготовки проб из организмов теплокровных
животных для экспериментальных исследований.
Получение крови. Кровь у мелких лабораторных животных
(мыши, крысы) можно получить из хвоста или из сердца в случае вскрытия животных
(для электронной микроскопии оптимально иметь не менее 30 мм3
сыворотки крови). После забора крови пробирки типа Эппендорф закрывают крышками
и центрифугируют на небольшой скорости (до 2000 g) в течение 10 с - 1 мин,
чтобы сбросить капельки крови, осевшие на стенки пробирок, не дав им высохнуть.
Для получения сыворотки кровь следует поставить в термостат
на 37 °С на 30 мин, после чего центрифугировать в течение 10 мин на скорости
2000 g. Отбирают сыворотку, не задевая тромба, в отдельную пробирку, которую
маркируют соответствующим образом. Сыворотку следует получать не позже, чем
через 2 ч после отбора крови, чтобы избежать гемолиза. Маркированные пробирки
замораживают и хранят при температуре -20 °С.
Для получения плазмы кровь отбирают в пробирки, куда
предварительно внесен раствор гепарина (10 ед./см3). Пробирки
центрифугируют в течение 10 мин на скорости 2000 g. Отбирают плазму, не задевая
клеток, в отдельную пробирку, которую маркируют (например, П - плазма) Пробирки
с оставшимся осадком (клетками крови) маркируют КК - клетки крови.
Маркированные пробирки замораживают и хранят при температуре -20 °С.
Получение органов животных. При вскрытии животных
выделяют последовательно почки, печень, желудок, кишечник, селезенку, легкие,
сердце, брызжеечные, подмышечные и другие лимфатические узлы, после вскрытия
черепной коробки животного - головной мозг. Выделенный орган с помощью пинцета
немедленно помещают в чашку Петри с фосфатно-солевым буфером pH 7,2 - 7,4 и
промывают от крови. Желудок и кишечник освобождают от содержимого и тщательно
промывают фосфатно-солевым буфером pH 7,2 - 7,4. В зависимости от цели
исследования органы переносятся в соответствующие фиксирующие жидкости или
замораживаются в жидком азоте или с помощью сухого льда.
По возможности органы одного и того же животного
используются для проведения различных видов анализа.
Для приготовления срезов тканей для электронной
микроскопии орган разрезают острой бритвой на куски размером
1×1×1 мм (6 кусков от одного органа одного животного). Куски
пинцетом переносят в пенициллиновые флаконы с фиксатором (2,5 % глутаровый
альдегид на однократном 0,1 М фосфатно-солевом буфере pH 7,2 - 7,4 с
добавлением 2 % нейтрального формалина) из расчета 4 см3 на один
флакон.
Из таких тканей и органов, как мышцы, печень и другие
железистые органы, кусочки могут быть вырезаны произвольно. Из таких органов,
как сердце, мозг, почка, кусочки вырезают из нужного отдела, например, отдельно
из областей коркового и мозгового вещества почки, из областей предсердий или
желудочков сердца и т.д. Такие органы, как желудочно-кишечный тракт и кожа,
требуют ориентации при фиксации. Для этого поперечные срезы кожи и определенных
отделов желудочно-кишечного тракта прикладывают на небольшие кусочки бумаги и в
таком виде помещают в фиксатор. Пробы из одного органа от одного животного
помещают в один флакон.
Из разных отделов желудка и кишечника вырезают кусочки
площадью 1 мм2 (объемом не более 1 мм3), переносят в
пенициллиновые флаконы с фиксатором. У мелких грызунов берут фрагмент кишечника
и заливают фиксатором в расправленном виде. Отношение объема фиксатора к
фиксируемой ткани должно быть не менее 10:1. Пробы из одного органа от одного
животного помещают в один пузырек.
Каждый флакон маркируют специальным химически стойким
маркером либо восковым карандашом, либо приклеивают бумажную этикетку, запись
на которой делают карандашом. На этикетке должен указываться номер животного и
название органа, а также вид анализа, для которого подготовлена проба.
Пробы, направляемые в лабораторию, снабжают этикеткой и
актом отбора проб, в котором указывают место, время отбора, объект, орган,
подписи лиц, отбиравших пробу.
Возможно длительное (до 2 месяцев) хранение образцов в
фиксаторе при температуре 4 °С. Нельзя допускать замораживание образцов, т.к.
образующиеся кристаллы льда разрушают ткани.
Для приготовления тканевых гомогенатов для электронной
микроскопии из органов вырезаются фрагменты размером от 5×5×5
мм до 10×10×10 мм, фрагменты большего размера предпочтительнее,
небольшие органы или органы мелких животных можно фиксировать целиком. Органы
или их фрагменты помещают в небольшие (порядка 1 см3) открытые
емкости (лунки блистеров) с однократным 0,1 М фосфатно-солевом буфером pH 7,2 -
7,4, каждая из которых маркируется отдельно путем погружения в заливочную среду
этикетки (надпись выполняется карандашом). Замораживание производится жидким
азотом в морозоустойчивом теплоизолированном сосуде с широким горлом. Пробы,
направляемые в лабораторию, снабжают этикеткой и актом отбора проб, в котором
указывают место, время отбора, объект, орган, подписи лиц, отбиравших пробу.
Замороженные пробы быстро заворачивают в фольгу каждую в отдельности и
погружают в сосуд Дьюара или термос с жидким азотом для долговременного
хранения. Можно также использовать колотый сухой лед в морозоустойчивой
термоизолирующей (например, пенопластовой) емкости. Емкость должна быть
герметически закрыта. Для длительного хранения препараты извлекаются из жидкого
азота и помещаются в низкотемпературный холодильник с температурой не выше -80
°С. В таких условиях пробы могут храниться в течение длительного времени.
5.1.5.3. Методы подготовки образцов продукции
животноводства.
Для определения содержания наноматериалов в мясе и
субпродуктах скота или птицы из разных областей мышечной ткани, печени, сердца,
почек, желудка и других органов скальпелем срезают наружный слой и вырезают
кусочки размером примерно 2×2×2 см.
Для приготовления срезов тканей для электронной
микроскопии разрезают полученные куски острой бритвой на кусочки размером
1×1×1 мм (6 кусочков от одной пробы), которые пинцетом переносят в
пенициллиновые флаконы с фиксатором (2,5 % глутаровый альдегид на 0,1 М
фосфатно-солевом буфере pH 7,2 - 7,4 с добавлением 2 %-го нейтрального
формалина) из расчета 4 см3 на один флакон. Отношение объема
фиксатора к фиксируемой ткани должно быть не менее 10:1. Кусочки от каждой
пробы помещают в отдельный маркированный пузырек. На этикетке должен быть
указан изготовитель продукции, название и номер партии, а также вид анализа,
для которого подготовлена проба. Пробы, направляемые в лабораторию, снабжают
этикеткой и актом отбора проб, в котором указывают место, время отбора, объект,
органы, подписи лиц, отбиравших пробу. Возможно длительное (до 2 месяцев)
хранение образцов в фиксаторе при температуре 4 °С. Нельзя допускать
замораживание образцов, т.к. образующиеся кристаллы льда разрушают ткани!
Для приготовления тканевых гомогенатов для электронной
микроскопии вырезаются фрагменты размером от 5×5×5 мм до
10×10×10 мм. Фрагменты помещают в небольшие (порядка 1 см3)
открытые емкости (лунки блистеров) с однократным 0,1 М фосфатно-солевом буфером
pH 7,2 - 7,4, каждая из которых маркируется отдельно путем погружения в
заливочную среду этикетки (надпись выполняется карандашом). Замораживание
производится жидким азотом в морозоустойчивом теплоизолированном сосуде с
широким горлом. Пробы маркируют так же, как и образцы тканей. Замороженные
пробы быстро заворачивают в фольгу каждую в отдельности и погружают в сосуд
Дьюара или термос с жидким азотом для долговременного хранения. Также можно
использовать колотый сухой лед в морозоустойчивой термоизолирующей (например,
пенопластовой) емкости. Емкость должна быть закрыта, чтобы уменьшить
теплообмен. Для длительного хранения препараты извлекаются из жидкого азота и
помещают в низкотемпературный холодильник с температурой не более -80 °С. В
таких условиях пробы могут храниться в течение длительного времени.
Гомогенаты тканей готовят для упрощения и ускорения детекции
наночастиц в тканях в случае, если распределение наноматериалов в клетках и
тканях не имеет значения.
Для приготовления образцов молока из транспортной
тары или потребительской упаковки отбирают 15 см3 в пластиковую или
стеклянную пробирку с герметично закрывающейся пробкой.
5.1.5.4. Приготовление образцов для электронной микроскопии.
Поступившие образцы разделяют на 2 группы. Первая группа
образцов подвергается оптимизированной процедуре пробоподготовки, полностью
исключающей контрастирование образцов, которое маскирует наличие наночастиц.
Образцы из первой группы используются в дальнейшем для оценки наличия
наночастиц и их морфологии, а также для статистического анализа частоты
встречаемости наночастиц. Вторая группа подвергается стандартной процедуре
проводки и контрастирования, чтобы можно было оценить состояние ткани в
контроле и при действии наночастиц, а также выяснить локализацию наночастиц. Все
процедуры проводят только в стеклянной посуде!
Важным пунктом подготовки образца к
электронномикроскопическому исследованию является подготовка бленд (сеточек) и
нанесение на них формваровой пленки. Следует учитывать, что попадание
чужеродных частиц на пленку на этом этапе является существенным фактором,
приводящим к артефактам в последующих измерениях.
Для нанесения формваровой пленки на сеточки и бленды может
быть использована следующая методика.
Мытье бленд или сеток: поместить бленды или сетки в 30 %-ю
соляную кислоту на 1 мин при комнатной температуре; промыть бленды в
дистиллированной воде 10 раз; промыть бленды в ацетоне (градация хч) 3 раза и
высушить на воздухе; хранить бленды в герметично закрытой емкости, чтобы
избежать попадания пыли.
В том случае, если сетки используют повторно, перед
процедурой промывания их обрабатывают ультразвуком. Сетки помещают в стеклянную
колбу с дихлорэтаном и погружают в ультразвуковую ванну, наполненную водой. При
использовании ультразвуковой ванны с пьезокерамическим преобразователем с
выходной мощностью 0,06 кВт обработку проводят при 37 или 44 кГц в течение 10 -
15 мин. При использовании ванн с большей мощностью время обработки можно
снижать пропорционально мощности, но не меньше 5 мин.
Приготовление пленки:
- приготовить 0,3 %-й раствор формвара в дихлорэтане
(градация хч) в узкой стеклянной емкости с притертой крышкой. Полное
растворение достигается за 3 дня. Хранить в темноте;
- чистое предметное стекло опустить в емкость с формваром,
вынуть, поставить стекло ребром на фильтровальную бумагу для удаления излишков
формвара и высушить. Процарапать препаровальной иглой прямоугольник по краю
стекла. Подготовить широкую емкость с дистиллированной водой (удобно
использовать кристаллизатор). Дистиллированная вода наливается в емкость до
образования выпуклого мениска. Удалить пыль с поверхности воды с помощью
стеклянной палочки или пипетки. Удаление пыли обязательно, иначе пыль попадет
на формваровую пленку. Коротко подышать на стекло с формваровой пленкой и
медленно погрузить его в емкость с водой. В процессе погружения формваровая
пленка отделится от стекла.
Вымытые бленды помещаются на поверхность пленки с помощью
пинцета. Пленка вылавливается на чистое предметное стекло, которое помещают в
чашку Петри для последующего высушивания.
5.1.5.4.1. Подготовка срезов тканей для детекции
наноматериалов методом ПЭМ (без контрастирования):
а) фиксатор отмывают 0,1 М фосфатно-солевым буфером pH 7,2 -
7,4 однократно 20-30 мин при комнатной температуре;
б) проводят обезвоживание образцов в водных растворах
этилового спирта:
- обрабатывают образцы 50 %-м этиловым спиртом 20 мин при 4
°С;
- обрабатывают образцы 60 %-м этиловым спиртом 2 раза по 20
мин при 4 °С;
- обрабатывают образцы 70 %-м этиловым спиртом в течение 12
ч при 4 °С (оставляют на ночь в холодильнике);
- обрабатывают образцы 80 и 96 %-м растворами этилового
спирта по 20 мин;
- обезвоживают образцы ацетоном 3 раза по 45 мин при
комнатной температуре;
в) проводят пропитку материала и последующую заливку в
эпоксидные смолы. Используют смесь Эпон 812, DDSA (додецил янтарный ангидрид),
MNA (метилэндиковый ангидрид) в соотношении 13:8:7. Для полимеризации
добавляется катализатор DMP-30 (тридиметиламинофенол);
г) для пропитки образцы при комнатной температуре помещают
на 2 ч в смесь смолы и ацетона 1:3, затем на 2 ч в смесь смолы и ацетона 1:1 и
на ночь (12 ч) в смесь смолы и ацетона 3:1. Перед окончательной заливкой
материал помещают на 2 ч в смолу. Для заливки используют специальные тефлоновые
платы с лунками для заливки (допустимо использование блистеров от таблеток);
д) полимеризацию материала проводят в течение 24 ч при 37
°С, затем в течение 48 ч при 60 °С. Окончательная твердость блока может быть
подобрана изменением соотношения смолы и катализатора;
е) из полученного блока с помощью лобзика выпиливают
прямоугольный участок, размером 2°×2×5 мм (ширина:ширина:высота).
Полученные блоки закрепляют в специальном держателе и затачивают острой бритвой
в виде усеченной пирамиды под бинокулярным микроскопом;
ж) срезы толщиной до 80 нм получают на ультрамикротоме с
помощью алмазного или стеклянного ножа. Срезы переносят на бленды или сетки,
покрытые формваровой пленкой и высушивают не менее 1 ч на воздухе. Данная
процедура должна выполняться опытным специалистом.
5.1.5.4.2. Подготовка с использованием стандартной процедуры
проводки и контрастирования:
а) образцы (кусочки ткани 1×1×1 мм) отмывают от
фиксатора 0,1 М фосфатно-солевым буфером pH 7,2 - 7,4 однократко 20 мин при
комнатной температуре;
б) образцы дофиксируют и контрастируют 1 %-м раствором четырехокиси
осмия (OsO4) на 0,1 М фосфатном буфере pH
7,2 - 7,4 в течение 2 ч. Раствор готовят разбавлением 2 % водного раствора OsO4 непосредственно перед использованием! (Глутаровый
альдегид лучше, чем четырехокись осмия фиксирует белки, но хуже стабилизирует
липиды, что и обусловливает использования обоих фиксаторов, как дополняющих
друг друга);
в) проводят обезвоживание образцов в водных растворах
этилового спирта:
- отмывают образцы от OsO4
холодным (4 °С) 50 %-м раствором этилового спирта 3 - 4 раза по 5 мин до
прекращения потемнения раствора. Использование холодного 50 %-го этанола
предотвращает выпадение осмия в осадок;
- обрабатывают образцы 60 %-м раствором этилового спирта 2
раза по 20 мин (4 °С);
г) проводят контрастирование образцов 2 %-м спиртовым (70
%-й раствор этилового спирта) раствором уранилацетата при 4 °С в течение 12 ч
(оставляют на ночь в холодильнике);
д) обезвоживают образцы холодным (4 °С) 80 и 96 %-м
раствором этилового спирта по 15 мин (комнатная температура). Использование
холодного 80 %-го раствора этилового спирта предотвращает выпадение в осадок
уранила;
е) обезвоживают образцы ацетоном 3 раза по 45 мин при
комнатной температуре;
ж) проводят пропитку материала и последующую заливку в
эпоксидные смолы, используя смесь Эпон 812, DDSA (додецил янтарный ангидрид),
MNA (метилэндиковый ангидрид) в соотношении 13:8:7. Для полимеризации
добавляется катализатор DMP-30 (тридиметиламинофенол);
з) для пропитки образцы при комнатной температуре помещают
на 2 ч в смесь смолы и ацетона 1:3, затем на 2 ч в смесь смолы и ацетона 1:1 и
на ночь (12 ч) в смесь смолы и ацетона 3:1. Перед окончательной заливкой
материал помещают на 2 ч в смолу. Для заливки используют специальные тефлоновые
платы с лунками для заливки (допустимо использование блистеров от таблеток);
и) полимеризацию материала проводят в течение 24 ч при 37
°С, затем в течение 48 ч при 60 °С. Окончательная твердость блока может быть
подобрана изменением соотношения смолы и катализатора;
к) из полученного блока с помощью лобзика выпиливают
прямоугольный участок, размером 2×2×5 мм (ширина:ширина:высота).
Полученные блоки закрепляют в специальном держателе и затачивают острой бритвой
в виде усеченной пирамиды под бинокулярным микроскопом. Такие органы, как кожа,
мышечные волокна, отделы желудочно-кишечного тракта требуют правильной
ориентации при изготовлении срезов. Предварительно изготавливают полутонкие
срезы толщиной 3 - 5 мкм с помощью пиромитома (используют стеклянный нож).
Срезы помещают на предметное стекло, окрашивают красителем толлуидиновым синим
(0,1 % раствор) и проверяют правильность ориентации с помощью светового
микроскопа. Для исследования кожи и отделов желудочно-кишечного тракта срез
должен проходить строго в поперечном направлении;
л) срезы толщиной до 80 нм получают на ультрамикротоме с
помощью алмазного или стеклянного ножа. Для выяснения локализации наночастиц
рекомендуется использовать серийные срезы;
м) срезы переносят на бленды или сетки, покрытые формваровой
пленкой, и высушивают не менее 1 ч на воздухе;
н) для анализа ультраструктуры клеток в присутствии
наночастиц полученные срезы контрастируют уранилацетатом и цитратом свинца 15
мин при комнатной температуре. Для этого срезы помещают в каплю 30 - 40 мм3
соответствующего раствора, нанесенную на парафильм в чашке Петри. Важным
моментом является необходимость при контрастировании цитратом свинца поместить
в чашку Петри рядом со срезами кристаллический NaOH для предотвращения
выпадения свинца.
5.1.5.4.3. Приготовление образцов для
определения наноматериалов в тканевых гомогенатах методом просвечивающей
электронной микроскопии.
Важным пунктом подготовки образца к
электронно-микроскопическому исследованию, является подготовка сеточек и
нанесение на них формваровой или углеродной пленки.
Процедура нанесения формваровой пленки на сеточки аналогична
описанной для бленд в разделе «Пропись приготовления образцов для определения
наноматериалов в срезах тканей методом просвечивающей электронной микроскопии».
Для получения сеток с углеродной пленкой необходимо вначале
напылить слой углерода на поверхность слюды, непосредственно перед напылением
расщепленную для получения чистой гладкой поверхности. Напыление производят с
помощью прибора для напыления пленок углерода в вакууме (например, Emitech
К950Х фирмы «Emitech», Великобритания, или аналогичным). Напыление производят в
вакууме не выше 4 - 10 мБар импульсно, делают 2 - 4 импульса в течение 2 - 5 с
с перерывами по 30 с между ними. Готовую пленку спускают на поверхность
дистиллированной воды, налитой в непрозрачный контейнер. Предварительно отмытые
(как описано для бленд в разделе Пропись приготовления образцов для
определения наноматериалов в срезах тканей методом просвечивающей электронной
микроскопии») сетки для микроскопии укладывают на прямоугольный листок
фильтровальной бумаги, вырезанный по размеру углеродной пленки и помещенный на
поддерживающую сетчатую металлическую пластинку на расстоянии 1 - 2 мм под
поверхностью воды. Зажав пинцетом фильтровальную бумагу с сетками и
поддерживающей пластинкой, осторожно вылавливают углеродную пленку так, чтобы
она покрыла сетки. Фильтровальную бумагу с покрытыми углеродной пленкой сетками
помещают в чашку Петри или другую удобную посуду с поглотителем влаги в
термостат (50 °С) не менее, чем на 1 ч. Хранят сетки в закрытой чашке Петри или
другой удобной посуде:
а) образец замороженной ткани оттаивают при комнатной
температуре;
б) измельчают образец и готовят из него гомогенат с помощью
гомогенизатора;
в) дальнейшую подготовку гомогената к измерениям проводят по
одной из следующих методик:
- с использованием концентрированных неорганических
кислот:
а) помещают 40 мм3 приготовленного гомогената в
полипропиленовую пробирку;
б) добавляют 30 мм3 концентрированной азотной
кислоты, перемешивают смесь;
в) помещают смесь в термостат (37 °С) на ночь;
г) после инкубации нейтрализуют смесь 10 М раствором NaOH,
проверив pH смеси универсальным индикатором.
Недостаток такой методики - образование многочисленных
кристаллов соли при переносе и высушивании образца на сеточке для электронной
микроскопии;
- с использованием протеазы «Флавозим»:
а) помещают 40 мм3 приготовленного гомогената в
полипропиленовую пробирку;
б) добавляют протеазу «Флавозим» из расчета 1 г гомогената -
25 ед. активности протеазы, перемешивают смесь;
в) помещают смесь в термостат (50 °С) минимум на 6 ч,
оптимально на 20 ч.
Примечание: активность протеазы максимальна при pH 6,0;
- с использованием протеиназы К:
а) помещают 40 мм3 приготовленного гомогената в
полипропиленовую пробирку;
б) добавляют протеиназу К из расчета 1 г гомогената - 30 ед.
активности протеиназы, перемешивают смесь;
в) помещают смесь в термостат (37 °С) на 4 ч;
г) на чистую фильтровальную бумагу выкладывают медную
сеточку с предварительно нанесённой формваровой плёнкой или с напыленным тонким
слоем углерода;
д) на сеточку наносят 2,5 мм3 образца,
подготовленного из гомогената, сразу же стягивая края капли на фильтровальную
бумагу;
е) подсушивают сеточку на воздухе в течение 5 - 10 мин,
закрывая от попадания пыли крышкой чашки Петри или стеклянного бюкса, затем
переносят в бокс для хранения электронно-микроскопических образцов.
5.1.5.4.4. Приготовление образцов сыворотки или плазмы крови
для определения наноматериалов методом просвечивающей электронной микроскопии;
а) к 20 мм3 сыворотки или плазмы крови добавляют
5 мм3 10 %-го раствора додецилсульфата натрия;
б) к полученной смеси добавляют 5 мм3 раствора
протеиназы К (1 мг/см3);
в) инкубируют в термостате при 37 °С в течение 1 ч;
г) на чистый бумажный фильтр (типа Whatman или аналогичный)
выкладывают медную сеточку с предварительно нанесённой формваровой плёнкой или
с напыленным тонким слоем углерода;
д) на сеточку наносят 2,5 мм3 образца,
подготовленного из гомогената, сразу же стягивая края капли на фильтровальную
бумагу;
е) подсушивают сеточку на воздухе в течение 5 - 10 мин,
закрывая от попадания пыли крышкой чашки Петри или стеклянного бюкса, затем
переносят в бокс для хранения электронно-микроскопических образцов.
5.1.5.4.5. Приготовление образцов молока для определения
наночастиц методом ТЭМ:
а) помещают 40 мм3 образца в полипропиленовую
пробирку;
б) добавляют протеазу «Флавозим» из расчета на 40 мм3
молока - 0,1 ед. активности протеазы, перемешивают смесь;
в) помещают смесь в термостат (50 °С) минимум на 6 ч,
оптимально на 20 ч. Примечание: см. п. 5.1.5.4.3;
г) на чистую фильтровальную бумагу выкладывают медную
сеточку с предварительно нанесённой формваровой плёнкой или с напыленным тонким
слоем углерода;
д) на сеточку наносят 2,5 мм3 пробы молока, сразу
же стягивая края капли на фильтровальную бумагу;
е) подсушивают сеточку на воздухе в течение 5 - 10 мин,
закрывая от попадания пыли крышкой чашки Петри или стеклянного бюкса, затем
переносят в бокс для хранения электронно-микроскопических образцов.
5.1.6.
Методика проведения электронно-микроскопического анализа
Методика проведения анализа приводится для двух типов
образцов: для срезов тканей (органов) и жидких образцов (плазма крови, лизаты,
экстракты, гомогенаты тканей и органов и т.п.). Наиболее важное различие между
этими образцами заключается в том, что при анализе срезов существует
принципиальная возможность определить локализацию наночастиц в клетке или
ткани, а при анализе жидких образцов такой возможности нет.
Методика описана для случая регистрации сигнала с помощью
ПЗС-камеры и получения результатов сразу в цифровом виде. Настройка и юстировка
микроскопа проводится квалифицированным оператором согласно инструкции к
микроскопу.
5.1.6.1. Методика проведения анализа по выявлению
наночастиц, их идентификации, определению их размера и формы.
а) Анализ по выявлению наночастиц, их идентификации,
определению размера и формы проводится на препаратах гомогенатов, плазмы крови,
молока и неконтрастированных срезах тканей и органов. Толщина среза тканей и
органов не должна превышать 70 - 80 нм. Необходимо удостовериться, что на
срезе, полученном при нарезке блока, присутствует ткань.
б) Анализ проводится с использованием трех срезов, нарезанных
с одного и того же блока (образца), с участков блока, отстоящих друг от друга
не менее, чем на 100 мкм. Анализ жидких образцов проводится для трех сеточек с
образцом, нанесенным из одной и той же пробы (гомогенат, плазма крови, молоко)
после тщательного перемешивания пробы перед каждым нанесением на сеточку. В
качестве контроля используют чистый бленд или сеточку, чтобы удостовериться в
отсутствии контаминации бленда или сеточки посторонними наночастицами.
в) В зависимости от размера наночастиц, которые необходимо
обнаружить и охарактеризовать, выбираются параметры увеличения микроскопа и
размера оцифровываемого изображения в пикселах.
Выбор этих параметров диктуется разрешением, которое должно
быть обеспечено в оцифрованном изображении, чтобы можно было достоверно
провести анализ размера и формы наночастиц. Хотя электронный микроскоп
обеспечивает предельное разрешение лучше 0,5 нм, но из-за конечного размера
пиксела матрицы ПЗС, выбранной дискретности оцифровки изображения (размер
изображения в пикселах) разрешение в оцифрованном изображении Ru
может отличаться от предельного разрешения микроскопа.
Величина Ru с
учетом теоремы Найквиста будет определяться следующей формулой:
L - линейный размер поля
образца, отображаемый микроскопом на ПЗС-камере при выбранном увеличении, нм;
X - число пикселов в оцифрованном изображении
размером Х×X пикселов. Увеличение микроскопа обратно
пропорционально L.
Чтобы иметь возможность
определить форму наночастицы, в частности, отличить квадратную наночастицу от
круглой, необходимо, чтобы изображение наночастицы на ПЗС-матрице
проецировалось на площадку не менее 5×5 пикселов. Таким образом,
минимальный размер наночастицы ZM, для которой можно определить
форму при выбранных параметрах L и X, определяется формулой:
Таким образом, чтобы обеспечить достоверное определение по
изображению размера и формы наночастиц с минимальным размером Z,
необходимо выбрать параметры L и Х так, чтобы
При этом составляющая погрешности измерения размера
наночастицы δZu которую по ГОСТ
Р 8.563-96 можно отнести к погрешностям считывания значений измеряемой
величины со шкал и диаграмм, в случае использования оцифрованного изображения
составит:
В табл. 1 представлены
величины Ru, ZM, и δZu при различных увеличениях и двух размерах
изображений в пикселах для типичного электронного микроскопа, у которого при
увеличении 50000 размер поля, проецируемого на ПЗС-матрицу, составляет
3×3 мкм.
Таблица 1
|
Увеличение
|
L×L, нм
|
Х×Х, Пиксел
|
Ru, нм
|
ZM, нм
|
δZu, нм
|
|
10000
|
150×150
|
200×200
|
0,23*
|
0,4
|
0,08
|
|
50000
|
300×300
|
200×200
|
0,45*
|
0,8
|
0,15
|
|
40000
|
375×375
|
200×200
|
0,6
|
0,9
|
0,2
|
|
20000
|
750×750
|
200×200
|
1,1
|
1,9
|
0,4
|
|
10000
|
1500×1500
|
200×200
|
2,3
|
3,8
|
0,8
|
|
5000
|
300×300
|
200×200
|
4,5
|
7,5
|
1,5
|
|
2500
|
600×600
|
200×200
|
9
|
15
|
3
|
|
12500
|
1200×1200
|
200×200
|
18
|
30
|
6
|
|
10000
|
150×150
|
100×100
|
0,45
|
0,8
|
0,15
|
|
50000
|
300×300
|
100×100
|
0,9
|
1,5
|
0,3
|
|
40000
|
375×375
|
100×100
|
1,1
|
1,9
|
0,4
|
|
20000
|
750×750
|
100×100
|
2,3
|
3,8
|
0,8
|
|
10000
|
1500×1500
|
100×100
|
4,5
|
7,5
|
1,5
|
|
5000
|
300×300
|
100×100
|
9
|
15
|
3
|
|
2500
|
600×600
|
100×100
|
18
|
30
|
6
|
|
12500
|
1200×1200
|
100×100
|
36
|
60
|
12
|
|
*Следует учесть предельное разрешение конкретного микроскопа
|
г) После настройки микроскопа в
обычном режиме просвечивающей электронной микроскопии проводится
предварительный просмотр образца с небольшим увеличением (10000 -
25000×). Цель такого просмотра - оценить однородность распределения
наночастиц (электронноконтрастных компонентов образца) по образцу, выявить
наличие областей скопления электронно-плотного материала, сделать
предварительную оценку размера выявляемых наночастиц.
д) Области неоднородного скопления электронно-контрастного
материала подвергаются анализу с учетом выполнения условия Z ≥ ZM.
От разных участков образца в пределах каждой обнаруженной области измеряется 3
- 5 изображений, в которых должны быть представлены основные (по форме, размеру)
типы обнаруженных электронно-контрастных включений. Если таких областей больше
6, то по выбору оператора анализируются 6 областей неоднородного скопления
электронноконтрастного материала.
Изображения наночастиц необходимо сохранять в файл, обращая
внимание на то, чтобы на изображениях была масштабная метка.
Измерение изображений в режиме просвечивающей электронной
микроскопии дополняется (в зависимости от типа анализируемых наночастиц)
измерениями в режиме дифракции электронов или СХПЭЭ. Цель измерений в режимах
дифракции электронов и СХПЭЭ - получение данных для идентификации
электронно-контрастного материала и обоснованного отнесения его к определяемым
наночастицам.
е) После измерений областей неоднородного скопления
электронно-контрастного материала, а также в случае их отсутствия, оператор
намечает линию, проходящую через весь образец и вдоль этой линии измеряет 30
равномерно отстоящих друг от друга изображений в режиме просвечивающей
электронной микроскопии. Изображения наночастиц необходимо сохранять в файл,
обращая внимание на то, чтобы на изображениях была масштабная метка.
При увеличении 50000 расстояние между регистрируемыми
изображениями составляет 10 - 30 полей зрения. Количество пропускаемых полей
зрения меняется прямо пропорционально используемому увеличению: при увеличении
100000 пропускается 20 - 60 полей зрения; при увеличении 10000 пропускается 2 -
6 полей зрения. Если в образце обнаружены области неоднородного скопления
электронно-контрастного материала, то линия, вдоль которой измеряются
изображения, по возможности, должна пройти мимо этих областей. Для подсчета
пропускаемых полей рекомендуется использовать дефекты подложки или
неоднородности образца, контролируя по ним перемещение образца.
Если в поле зрения, от которого предполагается
регистрировать изображение, наночастицы отсутствуют, то записывать изображение
в файл не следует, однако количество таких полей зрения должно быть посчитано и
учтено при анализе плотности и однородности распределения наночастиц по
образцу.
Измерение изображений в режиме просвечивающей электронной
микроскопии дополняется (в зависимости от типа анализируемых наночастиц)
измерениями в режиме дифракции электронов или СХПЭЭ. Цель измерений в режимах
дифракции электронов и СХПЭЭ - получение данных для идентификации
электронно-контрастного материала и обоснованного отнесения его к определяемым
наночастицам.
ж) По окончании измерений следует конвертировать файлы с
полученными изображениями из внутреннего формата программного обеспечения к
прибору в форматы .jpeg или .tiff (8-битном), а спектры, измеренные в режиме
СХПЭЭ, конвертировать в форматы .xls или .txt.
5.1.6.2. Методика идентификации наночастиц
Методика элементного картирования с помощью СХПЭЭ применима
для обнаружения большинства элементов, за исключением следующих: Р, S, Cl, Zn,
Ga, Ge, As, Se, Br, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In. В том
случае, если для определяемых наночастиц возможно получение и электронограмм, и
спектров ХПЭЭ, предпочтение следует отдавать идентификации по спектрам ХПЭЭ.
В случае, если для определяемых наночастиц применим СХПЭЭ,
то идентификация осуществляется следующим образом:
- если в анализируемом поле зрения присутствует более 5
наночастиц, то целесообразно использовать режим элементного картирования:
- в соответствии с таблицами,
заложенными в программном обеспечении к микроскопу или базами данных по
спектрам ХПЭЭ выбираются значения энергий ΔEW1, ΔEW2
и ΔEWmax;
- с использованием энергетического
фильтра строятся три изображения, сформированных электронами, энергии которых
лежат в диапазонах (ΔEW1 - Δ/2; ΔEW1 +
Δ/2), (ΔEW2 - Δ/2; ΔEW2 + Δ/2) и
(ΔEWmax -
Δ/2; ΔEWmax + Δ/2);
- путем математической обработки
из этих трех изображений комбинируется карта распределения выбранного элемента.
Для обработки необходимо использовать специализированные программы, такие как
AxioVision от Zeiss;
- если в поле зрения, присутствует
не более 5 наночастиц, то рекомендуется измерить от каждой из них спектр ХПЭЭ.
Электронно-контрастные включения в анализируемых образцах
относят к определяемым наночастицам, если:
- они присутствуют, как в изображениях, измеренных в обычном
режиме просвечивающей электронной микроскопии, так и в изображениях, полученных
методом элементного картирования на основе СХПЭЭ;
- или спектры ХПЭЭ, измеренные от отдельных наночастиц в
анализируемом образце, соответствуют спектрам наночастиц стандартного образца.
Если методика СХПЭЭ неприменима для определяемых наночастиц,
и эти частицы являются кристаллическими, то для идентификации используют режим
дифракции электронов:
- для получения электронограммы в пределах поля зрения
необходимо выбирать ту область, в которой присутствует максимальное количество
наночастиц. Следует учитывать, что качественная электронограмма, как правило,
получается, если в области, ограничиваемой апертурной диафрагмой диаметром 1
мкм, присутствует не менее 20 наночастиц. Тем не менее, необходимо пробовать
получать дифракционные изображения и от областей, содержащих меньшее количество
наночастиц;
- если получаемые электронограммы имеют четкие рефлексы, эти
изображения должны быть сохранены. В противном случае достаточно сохранить
характерное изображение, показывающее, что от наночастиц в образце не удается
наблюдать информативной дифракционной картины.
Электронно-контрастные включения в анализируемых образцах
относят к определяемым наночастицам, если при наложении электронограмм,
измеренных от анализируемого образца, на электронограмму стандартного образца,
положение рефлексов анализируемых наночастиц совпадает с дифракционными
кольцами от стандартных наночастиц.
Если одновременно выполнены следующие условия:
- анализ с помощью СХПЭЭ невозможен;
- частицы настолько разрежены, что не удается получить
дифракционную картину, которую можно было бы сопоставлять с эталонной,
полученной от стандартного образца, то в этом случае идентификация должна
основываться на сопоставлении размеров и формы наночастиц в стандартном и
анализируемых образцах.
5.1.6.3. Методика проведения анализа по установлению
локализации наночастиц в срезах тканей и органов животных.
Данный анализ выполняется в случае достоверного выявления
наночастиц на срезах, не подвергавшихся контрастированию. Для анализа
локализации наночастиц используются срезы, приготовленные к анализу с
использованием стандартной процедуры проводки и контрастирования. Анализ
локализации наночастиц проводится с использованием трех срезов, нарезанных с
одного и того же блока (образца), с участков блока, отстоящих друг от друга не
менее, чем на 100 мкм.
При выполнении анализа локализации регистрируются
изображения в обычном режиме просвечивающей электронной микроскопии. Для
распознавания наночастиц на фоне контрастированных структур используют данные о
форме и размере наночастиц, обнаруженных на срезах, не подвергавшихся
контрастированию. Если методика СХПЭЭ применима для определяемых наночастиц, то
рекомендуется дополнительно проводить элементное картирование наночастиц с
использованием СХПЭЭ.
Обязательным является анализ локализации в участках неоднородного
скопления наночастиц, если такие участки были обнаружены на срезах, не
подвергавшихся контрастированию. Дополнительно характеризуется локализация
рассеянных наночастиц. Цель этого анализа сделать заключение:
- либо о структурах, в которых преимущественно локализуются
наночастицы,
- либо о неспецифичном (диффузном) распределении наночастиц
в клеточных и тканевых структурах.
При большом количестве наночастиц в анализируемых срезах
следует перечислить структуры, в которых наночастицы достоверно не обнаруживаются.
Идентификация тканевых и клеточных структур и заключение о
локализации наночастиц должны выполняться специалистом, имеющим опыт подобных
исследований.
5.1.7.
Обработка данных электронно-микроскопического исследования
Полученные изображения должны быть обработаны в программе
для обработки микроскопических изображений (рекомендуется свободно
распространяемая программа ImageJ, доступная в Интернете на сайте
http//rsb.info.nih.gov/ij/).
По полученным изображениям вычисляется среднее число частиц,
приходящихся на единицу площади образца. Для этого для каждого из имеющихся
кадров вычисляется количество наночастиц, приходящееся на единицу площади. К
полученной выборке добавляются пустые поля зрения, если они были обнаружены на
образце. По полученной выборке вычисляется среднее количество наночастиц,
приходящееся на единицу площади и среднее квадратичное отклонение этой
величины.
По полученным изображениям вычисляется средний размер
частиц. Для этого используются те изображения, на которых увеличение микроскопа
максимально. Если общее число частиц на всех полученных изображениях менее или
равно 100, то они все должны быть включены в выборку, которая будет
обрабатываться. Если общее число частиц на всех полученных изображениях более
100, то следует выбрать те изображения, на которых наночастицы видны наиболее
контрастно. По полученным результатам строится гистограмма распределения
наночастиц по размерам, проверяется ее нормальное (гауссовское) распределение
(рекомендации по выбору критериев проверки описаны в ГОСТ
8.207-76), вычисляется средний размер и среднее квадратичное отклонение.
Возможно использовать специальные функции для обработки изображений, которые
позволяют автоматизировать вычисления.
Для характеристики формы наночастиц используется один из
двух подходов:
- для каждой наночастицы, входящей в выборку, вычисляются
максимальный и минимальный размер, анализируется их отношение - форм-фактор;
- для каждой наночастицы вычисляется циркулярность  , где S - площадь, а р -
периметр наночастицы.
, где S - площадь, а р -
периметр наночастицы.
По форм-фактору (или по циркулярности) должна быть построена
гистограмма распределения, вычислено среднее и среднее квадратичное отклонение.
Если были измерены спектры ХПЭЭ, то следует определить край
поглощения пика искомого элемента, максимум пика, и сравнить эти параметры с
образцом сравнения. В случае, если образцом сравнения является стандартный
образец искомых наночастиц, край поглощения и максимум спектров поглощения
пиков должны совпадать.
Если была получена электронограмма от наночастиц в исследуемом
образце, то ее необходимо сравнить с эталонной электронограммой от стандартного
образца путем наложения.
5.1.8. Представление результатов
По результатам анализа готовится письменное заключение о
наличии или отсутствии наночастиц в образце. Если наночастицы были обнаружены,
то должны быть предоставлены:
- характерные изображения наночастиц в образце, измеренные
методом просвечивающей электронной микроскопии;
- для однородных образцов (молоко, гомогенаты, плазма,
сыворотка, тканевые экстракты, другие биологические жидкости) представляется
среднее число частиц, приходящееся на единицу площади, и среднее квадратичное
отклонение этой величины;
- гистограмма распределения наночастиц по размерам, средний
размер, его среднее квадратичное отклонение, а также сопоставление с
соответствующими данными для стандартного образца соответствующего
наноматериала;
- гистограмма распределения наночастиц по форм-фактору и/или
значению циркулярности, среднее значение форм-фактора (циркулярности) и ее
среднее квадратичное отклонение, а также сопоставление этих данных с
соответствующими данными для образца сравнения.
Если был снят спектр ХПЭЭ, то кроме самого спектра должен
быть приведен спектр, полученный от стандартного образца, а также изображение
области с наночастицами, от который он был получен. В случае проведения
элементного картирования приводится изображение, характеризующее распределение
анализируемого элемента.
Если была снята картина дифракции электронов, то должен быть
представлен результат ее сопоставления с электронограммой стандартного образца.
В отчёте о проведённом исследовании приводится
мотивированное заключение о локализации наночастиц, перечисляются клеточные и
тканевые структуры, в которых происходит накопление наночастиц, а также
отмечаются те структуры, в которых наночастицы достоверно не обнаружены.
6.1. Атомно-эмиссионная спектрофотометрия
6.1.1. Принцип метода
Метод основан на окислительно-кислотной «мокрой»
минерализации проб исследуемых биосубстратов и абиотических образцов и
последующем анализе их на входящие в состав наночастиц химические элементы
методом атомно-эмиссионной спектрометрии с использованием в качестве источника
возбуждения высокочастотной индуктивно связанной аргоновой плазмы. Переведение
компонентов образца, включая содержащиеся в нём наночастицы, в раствор
достигается обработкой проб концентрированной азотной кислотой при открытом и
автоклавном разложении. Полного предварительного разрушения органической
матрицы не требуется, поскольку это не сказывается на протекающей в плазме при
высокой температуре атомизации пробы и на процессах возбуждения эмиссионных
спектров атомов определяемых элементов, причём применение схемы последовательного
сканирования позволяет задавать необходимый список требуемых спектральных
эмиссионных линий, отвечающих определяемым элементам.
6.1.2.
Основные технические характеристики средств измерений
Рекомендуется использовать последовательный атомно-эмиссионный
спектрометр (типа Optima 2000™ DV и его серии Optima 4X00 DV или аналогичные),
которые представляют собой оптические спектрометры с полупроводниковыми
детекторами типа CCD (charge-coupled device) и с индуктивно связанной плазмой в
качестве источника возбуждения спектров. Рабочий диапазон длин волн таких
спектрометров составляет 165 - 800 нм при спектральном разрешении 0,007 (при
длине волны 193 нм). Спектральная полоса пропускания частот: 0,009 нм на 200
нм, 0,027 нм на 700 нм, монохроматор типа Эшелле. Экспозиция спектров
осуществляется автоматически в интервале 0,01 - 500 с, количество реплик -
произвольное. В спектрометре реализуется спектральная коррекция фона с помощью
алгоритма мультиспектральной фильтрации (MSF). Работа спектрометра полностью управляется
и контролируется программным обеспечением. Программное обеспечение позволяет
осуществлять полную автоматизацию измерений и управление вспомогательными
системами для ввода проб, сохраняет результаты измерений, включая спектры, и
дает возможность повторной обработки информации без проведения дополнительных
измерений. Результаты анализа выводятся на монитор в требуемом формате,
сохраняются в виде файла на жестком диске компьютера и могут быть перенесены на
другие носители для дальнейшей обработки.
6.1.3.
Средства измерений, материалы, реактивы
6.1.3.1. Средства измерений.
|
Атомно-эмиссионный спектрометр с
радиочастотным электромагнитным генератором для возбуждения индуктивно связанной
аргоновой плазмы, оборудованный устройством для контроля скоростей потока
аргона, компьютером для обработки выходных сигналов спектрометра с
возможностью коррекции фоновых сигналов, имеющий сертификат
Ростехрегулирования, зарегистрированный в Государственном реестре средств
измерений
|
|
|
Весы аналитические электронные с
пределом допускаемой погрешности ±0,0005 г
|
ГОСТ
24104-2001
|
|
Термоблок фирмы «Экрос» (мод.
4020) или аналогичный с 30 или более гнездами для фторопластовых цилиндров,
вместимостью 20 см3 (возможно использование установок для
микроволновой пробоподготовки со фторопластовыми вкладышами в автоклавы)
|
|
|
Аквадистиллятор электрический
одноступенчатый или двухступенчатый
|
ГОСТ
28165-89
|
|
Мембранная комбинированная
установка для получения деионизованной воды типа «Водолей» или аналогичная
|
|
|
Дозаторы с переменным объёмом
дозирования «Gilson»:
|
|
|
- 0,2 - 2,0 мм3 с шагом
0,01 мм3, с точностью ±1,2 %
|
|
|
- 2 - 20 мм3 с шагом 0,01
мм3, с точностью ±0,8 %
|
|
|
- 1 - 10 см3 с шагом
0,1 см3, с точностью ±0,5 %
|
|
|
Дозаторы «Ленпипет»:
|
ТУ 9452-002-33189998-2002
|
|
- 0,5 - 10,0 мм3 с
шагом 0,01 мм3, с точностью ±0,8 %
|
|
|
- 20 - 200 мм3 с шагом
0,1 мм3, с точностью ±0,6 %
|
|
|
- 100 - 1000 мм3 с
шагом 1 мм3, с точностью ±3 %
|
|
|
Стаканы химические термостойкие,
вместимостью 100 - 150 см3
|
ГОСТ
25336-82
|
|
Пробирки тефлоновые градуированные
на 10 см3
|
|
|
Одноразовые полипропиленовые
градуированные центрифужные пробирки без крышек, емкостью 15 см3,
для хранения растворенных образцов
|
|
|
Одноразовые полипропиленовые градуированные
центрифужные пробирки с винтовыми крышками, емкостью 50 см3, для
хранения рабочих стандартов
|
|
|
Цилиндр мерный, вместимостью 100
см3
|
ГОСТ
1770-74
|
|
Стаканчики для взвешивания
|
ГОСТ
25336-82
|
|
Ультразвуковая ванна УЗВ-9,5 или
аналогичная
|
ТУ 5252-378-0860808-96
|
6.1.3.2. Реактивы и материалы.
|
Кислота азотная концентрированная,
осч или очищенная методом перегонки в кварцевой или в термостойкой
полипропиленовой посуде
|
ГОСТ
11125-84
|
|
Аргон газообразный высокой чистоты
|
ТУ
6-21-12-94 (с изм. 1, 2)
|
|
Вода дистиллированная по
|
ГОСТ 6709-79
|
|
Ацетон, осч
|
ТУ 2633-039-44493179-00
|
|
Индий (III) азотнокислый (осч или
импортный аналог)
|
|
|
Стандартные образцы состава
растворов одно- и многоэлементные для атомно-эмиссионной спектрометрии
|
|
|
Скальпель
|
ГОСТ
21240-89
|
|
Фильтровальная бумага
|
|
|
Защитная лабораторная пленка типа
Parafilm «М» или подобная
|
|
6.1.4.
Требования к безопасности проведения работ
При работе с химическими веществами и реактивами необходимо соблюдать
требования техники безопасности, установленные для работ с токсичными, едкими и
легковоспламеняющимися веществами по ГОСТ
12.4.021-75.
Рабочие столы и поверхности должны содержаться в чистоте. В
конце рабочего дня после отключения всех приборов производится влажная уборка
рабочих поверхностей.
Безопасность при работе с электроустановками обеспечивается
по ГОСТ
12.1.019-79. Помещение для проведения измерений должно соответствовать
установленным требованиям. При выполнении работ должны быть соблюдены меры
противопожарной безопасности в соответствии с установленными требованиями.
Требования безопасности должны соответствовать правилам, установленным в
техническом описании на приборы.
6.1.5.
Требования к квалификации лиц, работающих на спектрометре
К выполнению измерений на спектрометре допускаются лица,
имеющие опыт работы с оптическими средствами измерений типа атомно-эмиссионного
спектрометра с индуктивно связанной плазмой, подтвержденный аттестатом фирмы,
выпустившей прибор; изучившие техническое описание измерительного прибора и
методику выполнения измерений; обученные в соответствии с ГОСТ
12.0.004-90 и прошедшие инструктаж по технике безопасности на рабочем месте
и ознакомленные с правилами обслуживания спектрометра. К проведению
пробоподготовки допускаются лица, имеющие опыт работы в химической лаборатории.
6.1.6. Условия выполнения измерений
Выполнение измерений проводят при нормальных климатических
условиях испытаний. Помещение не должно содержать токсичных паров и газов.
Температура окружающего воздуха в лаборатории 18 - 25 °С. Атмосферное давление
84 - 106 кПа (630 - 800 мм рт. ст.). Влажность воздуха 80 ± 5 % при температуре
25 °С. При использовании электроприборов частота переменного тока 50,0 ± 0,2
Гц, напряжение сети 220 ± 10 В. Освещение помещения естественное или
искусственное, не ограничивается особыми требованиями.
6.1.7.
Подготовка к проведению измерений
Все процедуры подготовки проб к анализу должны исключать
возможность внесения в них загрязнений. Используемую для пробоподготовки
фторопластовую посуду тщательно промывают в ультразвуковой ванне в разбавленной
1:1 азотной кислоте и трижды ополаскивают деионизованной водой.
6.1.8.
Отбор, хранение и подготовка проб
Образцы биологических проб от животных, растений,
сельскохозяйственного сырья и других объектов отбирают по методикам пробоотбора
для соответствующих видов продукции. Полученная масса образцов должна
составлять не менее 1 г в случае определения одного элемента и не менее 3 - 5 г
при одновременном определении до 20 элементов. В случае длительного хранения
образцы помещают в герметичные одноразовые пробирки и замораживают до -18 °С
либо лиофилизируют.
Разложение проб биосубстратов проводят следующим образом.
а) Жидкие образцы. Открытое разложение. Навеску
анализируемого объекта берут на аналитических весах во фторопластовые цилиндры
(типа PTFE, Viton™, Teflon™, PFA), определяя массу навески с точностью ±0,001 г
по разнице массы цилиндра до и после взятия навески. В цилиндр приливают 0,3 -
1,0 см3 концентрированной азотной кислоты, накрывают лабораторной
пленкой и помещают в термоблок, разогретый до 115 °С. Выдерживают в термоблоке
в течение 0,5 - 1,0 ч до гомогенизации пробы. Растворенный образец
количественно переносят в мерную полипропиленовую пробирку, троекратно смывая
со стенки цилиндра, и доводят деионизованной водой до 10 см3.
Герметично закрывают защитной плёнкой, перемешивают и направляют на анализ.
б) Плотные образцы. Микроволновая пробоподготовка.
Указанную выше в данном пункте навеску анализируемого образца помещают во
фторопластовый вкладыш и добавляют 5 см3 азотной кислоты. Автоклав с
пробой во вкладыше помещают в микроволновую печь и разлагают пробу, используя
программу разложения, рекомендованную изготовителем микроволновой печи. В общем
случае для мягких тканей животных, сельскохозяйственного сырья можно применять
следующий режим нагрева: подъем температуры до 200 °С в течение 5 мин,
выдерживание в течение 5 мин при 200 °С, охлаждение до 45 °С. Охлажденный
автоклав встряхивают для перемешивания содержимого и приоткрывают крышку для
уравновешивания давления. Качественно разложенная проба после отгона окислов
азота должна представлять собой бесцветный или желтоватый прозрачный раствор,
без не растворившихся частиц на дне и на стенках вкладыша. Растворенную пробу
количественно переносят в пробирку объемом 15 см3, троекратно
встряхивая вкладыш с крышкой с 1 см3 деионизованной воды и перенося
каждый смыв в пробирку, доводят объем до 10 см3 деионизованной
водой, закрывают и перемешивают. Автоматическим дозатором со сменным
наконечником отбирают аликвотную часть 1 см3 и доводят до 10 см3
0,5 %-ной азотной кислотой, закрывают защитной лабораторной пленкой, передают
на анализ. Данные об объеме аликвотной части и объеме разведения вводят в
программное обеспечение спектрометра вместе с названием и навеской образца.
Допускается непосредственный отбор аликвотной части объемом
0,1 - 0,5 см3 из разложенной пробы в автоклаве. Чтобы
скомпенсировать при этом погрешность разбавления, перед разложением в пробу
нужно добавить раствор внутреннего стандарта (In или Rh), чтобы концентрация
внутреннего стандарта в конечном растворе, направляемом на анализ, составляла
примерно 10 мкг/дм3 (например, добавить в пробу 100 мм3
раствора, содержащего 10 мг/дм3 Rh, затем из 5 см3
разложенной пробы взять аликвотную часть 0,5 см3 и довести до 10 см3).
Раствор внутреннего стандарта необходимо добавлять во все холостые пробы и в
калибровочные растворы. Заданную концентрацию внутреннего стандарта (10 мкг/дм3)
в холостых и стандартных растворах необходимо точно соблюдать.
Раствор холостой пробы готовят с выполнением всех указанных
выше операций, за исключением операции взятия навески.
6.1.9.
Приготовление стандартных градуировочных растворов
Рабочие стандартные растворы готовят разбавлением
стандартных опорных многоэлементных растворов. Опорные стандарты приготавливают,
смешивая определенные количества одноэлементных стандартных растворов для
атомной спектрометрии. При этом учитывают матрицы исходных растворов для
исключения потерь элементов вследствие соосаждения и сорбции. Пропорции и
концентрации элементов в опорных растворах подбирают таким образом, чтобы после
разбавления в 20 - 50 раз получались концентрации одного порядка с верхними
границами диапазона ожидаемых содержаний элементов в исследуемых образцах,
разложенных по стандартной методике, исходя из навески 0,1 г на 10 см3
конечного раствора. Приготовленные 10 - 50 см3 опорных стандартов
сохраняют в полипропиленовых или полистироловых контейнерах.
Приготовление рабочих стандартов состоит в доведении
аликвотной части опорного раствора до требуемого объема разбавленной (1:14)
азотной кислотой или деионизованной водой (для водных растворов). Рассчитывают
концентрации приготовленных растворов и вводят в память компьютера в файл
программного пакета. В готовый рабочий стандарт добавляют внутренний стандарт -
раствор азотнокислого индия с концентрацией ~1000 мг/дм3 по In, из
расчета 100 мм3 на каждые 10 см3 стандарта. Рабочие
стандарты сохраняют и расходуют в течение 1 - 5 рабочих дней. Пример состава
рабочих растворов приведен в табл. 2.
Таблица 2
Рекомендуемый состав рабочих стандартных образцов
в методе атомно-эмиссионной спектрофотометрии
|
Элемент
|
Концентрация
в мкг/см3 (ррт)
|
|
Раствор
1 (4,2 % HNO3)
|
Раствор
2 (Н2O)
|
|
Аl
|
0,739
|
-
|
|
Be
|
0,030
|
-
|
|
Fe
|
2,015
|
-
|
|
K
|
10,387
|
-
|
|
Cd
|
0,097
|
-
|
|
Са
|
9,654
|
-
|
|
Со
|
0,097
|
-
|
|
Li
|
0,092
|
-
|
|
Mg
|
4,011
|
-
|
|
Mn
|
0,194
|
-
|
|
Cu
|
1,010
|
-
|
|
Na
|
17,321
|
-
|
|
Ni
|
0,194
|
-
|
|
Pb
|
0,482
|
-
|
|
Ti
|
-
|
0,150
|
|
P
|
-
|
4,626
|
|
Cr
|
0,195
|
-
|
|
Zn
|
4,010
|
-
|
|
In (внутренний
стандарт)
|
10
|
10
|
________
* Приготовление: 1 часть
концентрированной азотной кислоты на 14 частей деионизованной воды.
6.1.10. Подготовка прибора
Спектрометр подготавливают к работе в соответствии с
руководством пользователя (инструкцией) по эксплуатации. Необходимые режимы
работы устанавливают в соответствии с рекомендациями фирмы-изготовителя.
Рекомендуемый режим проведения измерений приведен в табл. 3. Для конкретного типа прибора оптимальные режимы могут
быть установлены экспериментально. После запуска прибора производят проверку
технических характеристик, выполняя тест эквивалентной фоновой концентрации, тест
на воспроизводимость, тест на предел обнаружения.
Таблица 3
Условия выполнения анализа на атомно-эмиссионном
спектрометре
|
Подводимая мощность
|
1300
Вт
|
|
Охлаждающий поток
|
15,00
л/мин
|
|
Вспомогательный поток
|
0,20
л/мин
|
|
Несущий поток
|
0,85
л/мин
|
|
Скорость подачи образца
|
1,50
л/мин
|
|
Обзор
|
Аксиальный
для всех элементов
|
|
Экспозиция
|
Автоматическая
для всех элементов, в интервале от 0,01 до 2,00 с
|
|
Количество реплик
|
3
|
|
Спектральная коррекция фона
|
Алгоритм
мультиспектральной фильтрации (MSF) в составе программного пакета
|
6.1.11.
Устранение мешающих влияний
Поправки на влияние фона при возникновении матричных
эффектов и подавление взаимного влияния определяемых элементов вследствие спектральных
наложений осуществляют при помощи программного обеспечения спектрометра в
соответствии с руководством по эксплуатации спектрометра. Спектральных
наложений избегают выбором наилучших аналитических длин волн в эмиссионных
спектрах определяемых элементов. Для устранения влияния линий - интерферентов и
фона плазмы применяют алгоритм мультиспектральной фильтрации помех и фона,
реализованный в программном обеспечении.
6.1.12.
Градуировка спектрометра
Градуировку спектрометра выполняют перед началом измерений
полностью подготовленных проб, используя градуировочные растворы при
параметрах, установленных по п. 6.1.10.
Нахождение градуировочной характеристики, обработка и хранение результатов
градуировки спектрометра выполняют с использованием программного обеспечения
спектрометра.
6.1.13.
Выполнение измерений
Ввод в спектрометр подготовленной пробы, измерение атомного
излучения элементов и концентрации определяемых элементов проводят при
нормальных климатических условиях испытаний в соответствии с п. 6.1.6 с учетом требований
руководства (инструкции) по эксплуатации спектрометра. Устанавливают
оптимальный режим регистрации спектров и измерений в соответствии с табл. 3. Интенсивность характеристического
излучения регистрируется фоточувствительным детектором после прохождения этого
излучения через монохроматор. Интенсивность и положение спектральных линий
измеряются и обрабатываются компьютерной системой спектрометра.
Для измерения используют спектральные линии элементов,
наиболее предпочтительные по совокупности характеристик. Важнейшими из них
являются интенсивность, отсутствие спектральных наложений, отношение сигнал/шум,
достигаемый предел обнаружения, эквивалентная концентрация фона (ЭКФ). При
отладке методики проводят измерения по 3 - 5 линиям на элемент, затем из них
выбирают наилучшую для постоянной работы.
6.1.14. Обработка результатов измерений
Аналитические сигналы обрабатывают при помощи программного
обеспечения спектрометра, используя градуировочные зависимости, рассчитываемые
методом наименьших квадратов, учет и коррекцию фона, при необходимости - учет
взаимного влияния измеряемых элементов. Результат определения на дисплее
отвечает среднему арифметическому из нескольких параллельных измерений
анализируемого элемента. Обработка результатов измерений должна соответствовать
ГОСТ
8.207-76. Результаты измерений выводятся на дисплей, сохраняются в файле на
жестком диске, после чего составляется протокол по форме, представленной в
табл. 4.
Таблица 4
Форма протокола оформления представления результатов
анализа
методом атомно-эмиссионной спектрофотометрии и
масс-спектрометрии с индуктивно связанной плазмой
|
Наименование
организации (заявитель)
|
|
|
Наименование
образца (пробы)
|
|
|
Время
и дата отбора пробы
|
|
|
Дата
доставки в лабораторию
|
|
|
Код
образца (пробы)
|
|
|
Количественный
химический анализ
|
|
Элемент
|
Результат
определения, мкг/г
|
Относительная
погрешность определения, %
|
Заключение
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оператор
(Ф. И. О.)
(подпись)
|
|
|
|
|
|
6.1.15.
Контроль качества измерений
Внутренний контроль качества результатов определения
микроэлементов (сходимость, воспроизводимость, точность) осуществляют с целью
получения оперативной информации о качестве анализов и принятия при
необходимости оперативных мер по его повышению. Оперативный контроль качества
осуществляют путем проведения анализа испытуемых проб и стандартного образца,
химический состав которого не должен отличаться от состава испытуемой пробы
настолько, чтобы потребовалось изменить методику проведения анализа.
Периодичность контроля воспроизводимости результатов анализа
определяется количеством рабочих измерений за контролируемый период и
определяется планами контроля. В работе участвуют два аналитика. Образцами для
контроля являются не менее двух проб, каждую из которых анализируют в точном
соответствии с прописью, максимально варьируя условия проведения анализа:
получают два результата, используя разные наборы мерной посуды, разные партии
реактивов и разные экземпляры стандартных образцов для градуировки прибора.
Результат контроля признается
удовлетворительным, если для каждой из тестированных проб выполняется условие:
X1 - результат
анализа рабочей пробы, мкг/г (см3);
Х2 - результат анализа этой же пробы,
полученный другим аналитиком с использованием другого прибора, другой мерной
посуды и другой партии реактивов, мкг/г;
D - допустимые расхождения между результатами анализа
одной и той же пробы, %. Значения D для определяемых элементов приведены
в табл. 5.
При превышении норматива оперативного контроля
воспроизводимости эксперимент повторяют. При повторном превышении указанного
норматива D выясняют причины, приводящие к неудовлетворительным
результатам работы и контроля, и устраняют их.
Периодичность контроля воспроизводимости результатов анализа
определяется количеством рабочих измерений за контролируемый период и
определяется планами контроля. При этом выполняют анализ стандартных образцов.
Рекомендуется использовать стандартные образцы наноматериалов, добавленные в
определённых количествах к свободным от них биологическим пробам. Содержание
определяемых элементов в образцах наноматериалов должно быть предварительно
аттестовано в установленном порядке.
Таблица 5
Погрешности измерений элементов
методом атомно-эмиссионной спектрофотометрии
|
Элемент
|
Диапазон содержаний, мкг/г
|
Относительная
погрешность, %, Р = 0,95
|
Элемент
|
Диапазон содержаний, мкг/г
|
Относительная
погрешность, %, Р = 0,95
|
|
Al
|
0,01
- 0,10
|
65
|
Mn
|
0,001 - 0,100
|
50
|
|
|
0,1
- 1,0
|
40
|
|
0,1 - 2,0
|
40
|
|
|
1
- 200
|
20
|
|
2 - 200
|
20
|
|
Be
|
0,01
- 0,10
|
65
|
Cu
|
0,05 - 0,50
|
50
|
|
|
0,1
- 1,0
|
40
|
|
|
40
|
|
|
1
- 10
|
20
|
|
5
- 10 000
|
25
|
|
Fe
|
0,02
- 0,20
|
65
|
Na
|
0,1
- 1,0
|
65
|
|
|
0,2
- 2,0
|
40
|
|
1
- 10
|
50
|
|
|
2
- 1 000
|
20
|
|
10
- 10000
|
25
|
|
K
|
0,01
- 0,10
|
65
|
Ni
|
0,05
- 0,50
|
80
|
|
|
0,1
- 1,0
|
50
|
|
0,5
- 5,0
|
50
|
|
|
1
- 10000
|
25
|
|
5
- 100
|
30
|
|
Cd
|
0,01
- 0,10
|
70
|
Pb
|
0,05
- 0,50
|
70
|
|
|
0,1
- 1,0
|
50
|
|
0,5 - 5,0
|
50
|
|
|
1
- 100
|
25
|
|
5
- 200
|
30
|
|
Са
|
0.01 - 0,10
|
50
|
Ti
|
0,001
- 0,010
|
50
|
|
|
0,1
- 1
|
40
|
|
0,01
- 1,00
|
35
|
|
|
1
- 10000
|
25
|
|
1
- 200
|
20
|
|
Со
|
0,01
- 0,10
|
70
|
P
|
0,5 - 50
|
70
|
|
|
0,1
- 1,0
|
50
|
|
5
- 50
|
50
|
|
|
1
- 100
|
30
|
|
50
- 5000
|
25
|
|
Li
|
0,01
- 0,10
|
70
|
Cr
|
0,01
- 0,10
|
70
|
|
|
0,1
- 1,0
|
50
|
|
0,1
- 1,0
|
50
|
|
|
1
- 100
|
30
|
|
1
- 100
|
25
|
|
Mg
|
0,1
- 1,0
|
50
|
Zn
|
0,01 - 0,10
|
70
|
|
|
1
- 10
|
40
|
|
0,1
- 1,0
|
50
|
|
|
10
- 1000
|
20
|
|
1
- 5000
|
25
|
Метод внутреннего стандарта.
Отбирают две пробы и к одной из них делают добавку в виде раствора таким
образом, чтобы содержание определяемого элемента увеличилось по сравнению с
исходным на 50 - 150 %. Каждую пробу анализируют в точном соответствии с
прописью методики и получают результат анализа исходной рабочей пробы X
и рабочей пробы с добавкой X1. Результаты анализа исходной
рабочей пробы X и рабочей пробы с добавкой X1 получают
в строго одинаковых условиях, т.е. их получает один аналитик с использованием
одного набора мерной посуды, одной партии реактивов и т.д.
Результаты контроля признаются
удовлетворительными, если выполняется условие:
Кд - норматив
оперативного контроля погрешности, мкг/г;
С - добавка к пробе в виде раствора с известной
концентрацией, мкг/г.
При внешнем контроле (Р =
0,95) значение Кдопределяют как
δ2х1, и δ2х2
- характеристики погрешностей для исходной пробы и пробы с добавкой, мкг/см3.
|
δ2х1
= 0,165Х1 и δ2х2
= 0,165Х
|
При внутрилабораторном контроле (Р = 0,90) принимают,
что
При превышении норматива
оперативного контроля погрешности эксперимент повторяют. При повторном
превышении указанного норматива выясняют причины, приводящие к
неудовлетворительным результатам контроля, и их устраняют.
Метод стандартных образцов. Выполняют анализ пробы,
приготовленной из стандартного образца, и сравнивают его результаты с
аттестованным содержанием элементов. Погрешность аттестации не должна быть
большей, чем 1/3 погрешности методики.
Результаты контроля признаются
удовлетворительными, если выполняется условие:
С - найденное содержание
элемента в пробе, приготовленной из стандартного образца;
А - аттестованное
содержание элемента в стандартном образце. При внутрилабораторном контроле (Р
= 0,90) принимают, что
При внешнем контроле (Р = 0,95) принимают
Δ - общая погрешность
результата анализа по методике.
При превышении норматива оперативного контроля погрешности
эксперимент повторяют. При повторном превышении указанного норматива выясняют
причины, приводящие к неудовлетворительным результатам контроля, и их
устраняют.
Оперативный контроль сходимости. Периодичность
контроля сходимости результатов анализа определяется количеством рабочих
измерений за контролируемый период и определяется планами контроля. Используют
результаты параллельных анализов.
Норматив оперативного контроля
сходимости рассчитывают по формуле:
cmaxи cmin -
соответственно наибольшее и наименьшее значения параллельных определений;
d -
норматив оперативного контроля воспроизводимости, d = 2,77
σ(Δ);
σ(Δ) - характеристика случайной составляющей
погрешности.
При превышении норматива оперативного контроля погрешности
эксперимент повторяют. При повторном превышении указанного норматива выясняют
причины, приводящие к неудовлетворительным результатам контроля, и устраняют их
путем корректирующих воздействий.
6.2.
Масс-спектрометрия с индуктивно связанной аргоновой плазмой
6.2.1. Принцип метода
Метод масс-спектрометрии с индуктивно связанной аргоновой
плазмой (ИСП-МС) комбинирует использование индуктивно связанной плазмы в
качестве источника ионов с квадрупольным масс-спектрометром, выступающем в роли
масс-анализатора (фильтра) и дискретно-динодным детектором, который
используется для регистрации отдельных ионов и их потоков. Индуктивно связанная
плазма, поддерживаемая в специальной горелке, способна эффективно возбуждать
однозарядные ионы из атомов вводимого образца. Далее ионы фокусируются
ионно-оптической системой (для удаления нейтральных частиц и фотонов используется
ионная оптика, отклоняющая положительно заряженные ионы от оси плазмы без
расфокусировки ионного пучка) и попадают в анализатор масс-спектрометра, где
разделяются по отношению массы к заряду (m/z). Соответствующий ионный поток регистрируется
детектором. Через масс-спектрометр в каждый момент времени пропускаются ионы со
строго определенным m/z, которые затем попадают в детектор для
количественной регистрации. Число соударений за единицу времени пропорционально
количеству атомов каждого определяемого изотопа в исходном образце. Линейный
диапазон зависимости интенсивности сигнала от концентрации на современных
приборах достигает девять десятичных порядков, позволяя в одном цикле
сканирования масс-спектра регистрировать и единичные импульсы от малых концентраций,
и ионные токи от высоких концентраций элементов. Для достижения такого широкого
динамического диапазона в современных ИСП-МС приборах применяется двойная
регистрация сигналов: импульсный режим одного сегмента детектора используется
для подсчета отдельных ионов и аналоговый режим другого - для регистрации
ионных токов. Таким образом, современные приборы ИСП-МС позволяют определять
концентрации элементов и отдельных изотопов на уровне от сотых долей
нанограммов до сотен миллиграммов на литр. Достигаемые пределы обнаружения,
высокие чувствительность и избирательность метода ИСП-МС позволяет
количественно определять во многих биологических материалах до 40 - 50 входящих
в состав образца химических элементов в течение 2 - 3 мин (без учета времени
пробоподготовки).
Для подготовки образцов биосубстратов к анализу методом
ИСП-МС допускается использование двух методов разложения: 1) кислотное
растворение в открытых сосудах, без полного разрушения органической матрицы; 2)
кислотное разложение («мокрое озоление») с использованием систем микроволновой
пробоподготовки. Метод открытого разложения характеризуется высокой
производительностью при небольшом расходе реактивов, малой поправкой на
холостой опыт. Однако он не применим для разложения материалов, содержащих
большое количество жира и конкрементов (жировые ткани, новообразования
внутренних органов и другие). Кроме того, имеется возможность частичной или
иногда полной потери летучих элементов (As, Hg, I, Se). Органическая матрица, сохраняющаяся
в растворах проб, может быть источником серьезных матричных помех при ИСП-МС
измерениях, ограничивающих определение и изотопный анализ некоторых элементов
(табл. 6).
Метод микроволнового разложения требует сложного
оборудования, но обеспечивает следующие преимущества:
- высокую производительность разложения;
- более полное разложение органической матрицы практически
любых биосубстратов;
- существенное уменьшение потерь летучих элементов при
разложении.
Таблица 6
Примеры распространенных полиатомных наложений в методе
ИСП-МС
|
Изотоп
|
Относительная
распространенность изотопа, %
|
Мешающий ион
|
Источник
помех
|
|
40Са+
|
96,9
|
40Ar+
|
Аргон
плазмы
|
|
56Fe+
|
91,7
|
38АrH+
|
Аргон
плазмы, вода
|
|
80Se+
|
49,6
|
40Аr2+
|
Аргон
плазмы
|
|
28Si+
|
92,2
|
12С16O+
|
Углерод
органической матрицы
|
|
44Са+
|
2,0
|
32C16O2+
|
Углерод
органической матрицы
|
|
48Ti
|
73,8
|
32S16O+
|
Сера
органической матрицы
|
|
51V+
|
99,7
|
35Сl16O+
|
Хлориды
матрицы, НСl растворителя
|
|
64Zn+
|
48,6
|
32S16O2+
32S2+
|
Сера
органической матрицы
|
|
75As+
|
100,0
|
40Аr35Cl+
|
Хлориды
образца, НСl растворителя
|
6.2.2. Основные технические характеристики
применяемого оборудования
Для измерений рекомендуется использовать масс-спектрометр, обладающий
следующими оптимальными характеристиками:
- полупроводниковый генератор плазмы, рабочая частота: 27
MHz;
- изотопная чувствительность:
- для легких масс ≤
5×10-7
- для тяжелых масс ≤
1×10-7
- диапазон сканирования масс, а. е. м.: 2 - 260;
- динамический диапазон системы детектирования: девять
порядков;
- рабочая частота радиочастотного генератора 3 MHz;
- пределы обнаружения: Be < 1,5 нг/л, In < 0.5 нг/л,
Bi < 0,5 нг/л;
- чувствительность (имп./с на 1 мг/л): 7Li >
30000, 89Y > 80000, 205Тl >
40000;
- кратковременная стабильность, СКО: < 3 %;
- долговременная стабильность, СКО: < 4 %;
- двузарядные ионы, Ва2+/Ва+: < 3
%;
- оксидные ионы, СеО/Се: < 1,5 %;
- уровень фона на массе 9: < 5 имп./с.
Для достижения лучших пределов обнаружения до уровня сотых
долей нг/м3 и устранения полиатомных наложений, вызванных матрицей
образцов и матрицей растворителя, а также газами плазмы (табл. 6), рекомендуется проводить измерения на приборах с
октопольной реакционной системой (ОРС). Лучшие пределы обнаружения на этих
приборах достигаются за счет уменьшения уровня фона и фокусировки ионов в
октопольной ячейке (ОРС), расположенной перед квадруполем масс-анализатора. Устранение
полиатомных наложений осуществляется путем удаления мешающих ионов в результате
физического процесса дискриминации по энергиям, происходящего за счет
столкновений молекул полиатомных образований и аналитов с молекулами инертного
газа гелия, напускаемого в ячейку. Использование гелия позволяет выполнять
мультиэлементный анализ во всем диапазоне массовой шкалы, при этом исключено
образование новых интерференций.
Программное обеспечение масс-спектрометра должно
обеспечивать выполнение следующих функций:
- поддержку следующих методов анализа: количественного,
полуколичественного (обзорного), методов изотопного отношения и изотопного
разбавления;
- проведение автоматических измерений без участия оператора;
для проведения автоматических измерений спектрометр должен быть оборудован
устройством автоматического пробоотбора;
- автоматизацию процедур калибровки и настройки шкалы масс и
рабочих параметров спектрометра;
- статистическую обработку и сохранение результатов в
общепринятых форматах;
- возможность повторной обработки данных без проведения
дополнительных измерений;
- возможность использования аппарата контроля качества для
оперативного автоматического управления ходом измерений в соответствии с
заданными критериями качества и расчет статистических параметров качества.
6.2.3.
Оборудование, материалы, реактивы
Для сведения к минимуму уровня лабораторного фона, все
операции по подготовке образцов к измерениям и сами измерения должны
проводиться в чистом помещении, в котором не скапливается пыль. Для анализа сверхнизких
концентраций, загрязнения из окружающей среды являются основным фактором,
ограничивающим пределы обнаружения методом ИСП-МС. Для подготовки образцов
необходимо пользоваться сосудами из фторопласта (типа PTFE, Viton™, Teflon™)
или перфторалкоксиполимера. Для временного хранения образцов и рабочих
градуировочных растворов используется одноразовая посуда из полипропилена
(пробирки вместимостью 15 - 20 см3 для хранения образцов и
вместимостью 50 см3 с винтовой крышкой для хранения рабочих
стандартов).
6.2.3.1. Средства измерений и
оборудование
|
Квадрупольный масс-спектрометр с
индуктивно связанной плазмой, имеющий сертификат Ростехрегулирования и
зарегистрированный в Государственном реестре средств измерений и
соответствующий перечисленным в п. 6.2.2
требованиям
|
|
|
Весы аналитические электронные с
пределом допускаемой погрешности ±0,0005 г
|
ГОСТ
24104-2001
|
|
Аквадистиллятор электрический
одноступенчатый
|
ГОСТ
28165-89
|
|
Установка для получения
деионизованной воды, обеспечивающая получение воды с удельным сопротивлением
15 - 18 МOм⋅см2
|
ТУ 2123-002-00213546-2004
|
|
Дозаторы жидкости ручные или
электронные автоматические с одноразовыми наконечниками, емкостью 0,5 - 10 мм3,
50 - 200 мм3 и 200 - 1000 мм3, обеспечивающие суммарную
погрешность дозирования на уровне ±1 %
|
|
|
Термоблок для фторопластовых
цилиндров, с возможностью нагрева до 120 °С и автоматического поддержания при
этой температуре или песчаная баня
|
|
|
Цилиндры фторопластовые (типа
PTFE, Viton™, Teflon™, PFA) емкостью 20 см3
|
ГОСТ
1770-74
|
|
Система микроволнового разложения
с контролем температуры и давления
|
|
|
Фторопластовые автоклавы емкостью
20 - 50 см3 для микроволнового разложения
|
|
|
Одноразовые полипропиленовые
градуированные центрифужные пробирки без крышек, емкостью 15 см3,
для хранения растворенных образцов
|
|
|
Одноразовые полипропиленовые
градуированные центрифужные пробирки с винтовыми крышками, емкостью 50 см3,
для хранения рабочих стандартов
|
|
|
Ультразвуковая ванна УЗВ-9,5 или
аналогичная
|
ТУ 5252-378-0860808-96
|
6.2.3.2. Реактивы и материалы
|
Кислота азотная концентрированная,
осч
|
ГОСТ
11125-84
|
|
Аргон сжатый или сжиженный,
высокой чистоты
|
ТУ
6-21-12-94
|
|
Вода деионизованная, с удельным
сопротивлением 15 - 18 МОм⋅см2
|
ТУ 2123-002-00213546-2004
|
|
Ацетон, осч
|
ТУ 2633-039-4493179-00
|
|
Стандартные сертифицированные
образцы состава растворов одно- и многоэлементные для масс-спектрометрии
|
|
|
Скальпель
|
ГОСТ
21240-89
|
|
Фильтровальная бумага
|
ГОСТ
12026-79
|
|
Пластиковые промывалки для
деионизованной воды и разбавленной азотной кислоты
|
|
|
Пленка лабораторная герметизирующая
типа Parafilm «М»® или аналогичная
|
|
6.2.4.
Требования к безопасности проведения работ
При работе с химическими веществами и реактивами необходимо
соблюдать требования техники безопасности, установленные для работ с
токсичными, едкими и легковоспламеняющимися веществами, установленными ГОСТ
12.4.021-75.
Рабочие столы и поверхности приборов и оборудования должны
содержаться в чистоте. В конце рабочего дня после отключения всех приборов
производится влажная уборка рабочих поверхностей.
Безопасность при работе с электроустановками обеспечивается
по ГОСТ
12.1.019-79. Помещение для проведения измерений должно соответствовать установленным
требованиям. При выполнении работ должны быть соблюдены меры противопожарной
безопасности согласно ГОСТ
12.1.004-85 ССБТ.
6.2.5.
Требования к квалификации лиц,
работающих на масс-спектрометре
К выполнению измерений на масс-спектрометре допускаются
лица, прошедшие обучение навыкам работы на приборе ИСП-МС, подтвержденное
аттестатом фирмы-производителя прибора; изучившие техническое описание
измерительного прибора и методику выполнения измерений; обученные в
соответствии с ГОСТ
12.0.004-90 и прошедшие инструктаж по технике безопасности на рабочем
месте. Для работы с источниками огнеопасных и токсичных газов допускаются лица,
прошедшие соответствующую подготовку. К проведению пробоподготовки допускаются
лица, имеющие опыт работы в химической лаборатории.
6.2.6. Условия выполнения измерений
Выполнение измерений проводят при нормальных климатических
условиях испытаний. Помещение не должно содержать токсичных паров и газов.
Температура окружающего воздуха в лаборатории 18 - 25 °С. Атмосферное давление
84 - 106 кПа (630 - 800 мм рт. ст.). Относительная влажность воздуха 75 ± 5 %.
Градиент температуры не должен превышать 1,5 °С/ч.
При использовании электроприборов частота переменного тока
50,0 ± 0,2 Гц, напряжение сети 220 ± 10 В.
Освещение помещения естественное или искусственное, не
ограничивается особыми требованиями.
6.2.7.
Подготовка к проведению измерений
Все процедуры подготовки проб к анализу должны исключать возможность
внесения в них загрязнений. Используемую для пробоподготовки фторопластовую
посуду тщательно промывают в ультразвуковой ванне в разбавленной 1:1 азотной
кислоте и трижды ополаскивают деионизованной водой.
6.2.8.
Отбор, хранение и подготовка проб
Образцы биологических проб от животных, растений,
сельскохозяйственного сырья и других объектов отбирают по методикам пробоотбора
для соответствующих видов продукции. Полученная масса образцов препаратов
должна составлять не менее 0,1 г в случае определения одного элемента и не
менее 0,3 - 0,5 г при одновременном определении до 20 элементов или при
проведении обзорного анализа. В случае длительного хранения препараты помещают
в герметичные одноразовые пробирки и замораживают до -18 °С либо лиофилизируют.
Разложение проб биосубстратов проводят следующим образом.
Плотные образцы. Открытое разложение. На
аналитических весах взвешивают навеску образца массой 0,01 - 0,10 г. Навеску
помещают во фторопластовый цилиндр (типа PTFE, Viton™, Teflon™, PFA), приливают
0,2 - 1,0 см3 концентрированной азотной кислоты, накрывают защитной
лабораторной пленкой и помещают в термоблок, разогретый до температуры 115 °С,
выдерживают в течение 0,5 - 1,0 ч до полного растворения пробы. Растворенный
образец количественно переносят в мерную полипропиленовую пробирку, троекратно
смывая со стенок цилиндра, и доводят деионизованной водой до 10 см3.
Герметично закрывают защитной лабораторной пленкой, перемешивают и передают на
анализ.
Жидкие образцы. Открытое разложение. Навеску анализируемого
образца 0,1 - 0,5 г (0,1 - 0,5 см3) взвешивают на аналитических
весах во фторопластовых цилиндрах (типа PTFE, Viton™, Teflon™, PFA), определяя
массу навески по разнице массы цилиндра до и после взятия навески. В цилиндр
приливают 0,3 - 1,0 см3 концентрированной азотной кислоты, накрывают
лабораторной пленкой и помещают в термоблок, разогретый до 115 °С. Выдерживают
в термоблоке в течение 0,5 - 1,0 ч до гомогенизации пробы. Растворенный образец
количественно переносят в мерную полипропиленовую пробирку, троекратно смывая
со стенок цилиндра, и доводят деионизованной водой до 10 см3.
Герметично закрывают защитной лабораторной пленкой, перемешивают и передают на
анализ.
Микроволновая пробоподготовка. Навеску образца 0,1 -
0,5 г помещают во фторопластовый вкладыш и добавляют 5 см3
концентрированной азотной кислоты. Автоклав с пробой во вкладыше помещают в
микроволновую печь и разлагают пробу, используя программу разложения,
рекомендованную производителем печи. В общем случае, для растительных и
животных тканей и биологических жидкостей можно применять следующий режим
нагрева: подъем температуры до 200 °С в течение 5 мин, выдерживание в течение 5
мин при 200 °С, охлаждение до 45 °С. Охлажденный автоклав встряхивают для
перемешивания содержимого и приоткрывают крышку для уравновешивания давления.
Качественно разложенная проба после отгона окислов азота должна представлять
собой бесцветный или желтоватый прозрачный раствор, без не растворившихся
частиц на дне и на стенках вкладыша. Растворенную пробу количественно переносят
в пробирку объемом 15 см3, троекратно встряхивая вкладыш с крышкой с
1 см3 деионизованной воды и перенося каждый смыв в пробирку, доводят
объем до 10 см3 деионизованной водой, закрывают и перемешивают.
Автоматическим дозатором со сменным наконечником отбирают аликвотную часть 1 см3
и доводят до 10 см3 0,5 %-й азотной кислотой, закрывают защитной
лабораторной пленкой, передают на анализ. Данные об объеме аликвотной части и
объеме разведения вводят в программное обеспечение спектрометра вместе с названием
и навеской образца.
Допускается непосредственный отбор аликвотной части объемом
0,1 - 0,5 см3 из разложенной пробы в автоклаве. Чтобы
скомпенсировать при этом погрешность разбавления, перед разложением в пробу
нужно добавить раствор внутреннего стандарта (In или Rh), чтобы концентрация
внутреннего стандарта в конечном растворе, направляемом на анализ, составляла
примерно 10 мкг/дм3 (например, добавить в пробу 100 мм3
раствора, содержащего 10 мг/л Rh, затем из 5 см3 разложенной пробы
взять аликвотную часть 0,5 см3 и довести до 10 см3).
Раствор внутреннего стандарта необходимо добавлять во все холостые пробы и в
калибровочные растворы. Заданную концентрацию внутреннего стандарта (10 мкг/л)
в холостых и стандартных растворах необходимо точно соблюдать.
Раствор холостой пробы готовят с выполнением всех указанных
выше операций, за исключением операции взятия навески.
6.2.9. Приготовление стандартных растворов
Рабочие стандартные растворы готовят путем смешивания
нескольких опорных многоэлементных стандартных растворов для
масс-спектрометрии, содержащих разные группы элементов. Для калибровки
спектрометра используются два - три рабочих стандарта, содержащих, например, по
10, 40 и 100 мкг/л всех элементов, за исключением ртути, содержание которой
составляет 1 и 4 мкг/л в первых двух стандартных растворах. Для более точного
определения элементов, входящих в состав наноматериалов, может потребоваться
применение стандартного раствора, в котором их концентрации были бы одного
порядка с верхними границами диапазона содержаний элементов в исследуемом
объекте, с учетом применяемого фактора разбавления. Приготовленные рабочие
растворы сохраняются в полипропиленовых пробирках объемом 50 см3.
Рекомендуется использовать рабочие стандарты для калибровки в течение 3 - 5 дней
после приготовления. Пример состава исходных растворов для калибровки приведен
в табл. 7.
Таблица 7
Пример состава рабочих стандартных растворов в методе
ИСП-МС
|
Исходные
стандартные растворы, концентрация
|
Элементы
|
|
Калибровочный стандарт для анализа
биологических и абиотических объектов, содержащих наночастицы 1,000 ppm:
|
Fe, K,
Са, Na, Mg; 10 ppm: Ag, Al, As, Ba, Be, Cd, Co, Cr, Cu,
Mn, Mo, Ni, Pb, Sb, Se, Tl, V, Zn, Th, U
|
|
Мультиэлементный калибровочный стандарт
№ 4, 10 мкг/см3
|
B, Ge, Mo, Nb, P, Re, Si, Та,
Ti, W, Zr
|
|
Мультиэлементный калибровочный стандарт
№ 3, 10 мкг/см3
|
Sb, Au, Hf, Ir, Pd, Pt, Rh, Ru, Те, Sn
|
|
Калибровочный стандарт Hg, 10 мкг/см3
|
Hg
|
6.2.10. Подготовка прибора
Масс-спектрометр подготавливают к работе в соответствии с
руководством пользователя (инструкцией по эксплуатации). Необходимые режимы
работы устанавливают в соответствии с рекомендациями производителя. Пример
режима проведения измерений приведен в табл. 8.
Для конкретного типа прибора оптимальные режимы могут быть установлены
экспериментально. После запуска прибора производят проверку рабочих
характеристик прибора, включая проверку чувствительности во всем диапазоне
масс, проверку уровня фона, уровня вторичных оксидных и двузарядных ионов,
воспроизводимости.
Таблица 8
Условия выполнения анализа на масс-спектрометре
с индуктивно-связанной плазмой
|
Параметр
|
Значение
|
|
Охлаждающий поток, дм3/мин
|
15
|
|
Вспомогательный поток, дм3/мин
|
1,2
|
|
Распыляющий поток, дм3л/мин
|
0,9
- 1,2
|
|
Подводимая мощность
|
1500
Вт
|
|
Распылитель
|
Кварцевый
концентрический или полимерный типа Бабингтона
|
|
Распылительная камера
|
Охлаждаемая
двухходовая, тип Скотта, материал - кварц
|
|
Скорость подачи образца, см3/мин
|
Менее
0,5
|
|
Конусы сэмплера и скиммера
|
Никелевые
или платиновые
|
|
Режим сканирования
|
3
точки на пик
|
|
Время интегрирования, мс
|
50
- 100 на массу
|
|
Число реплик
|
3
|
|
Полное время измерения образца, с
отмывкой, мин
|
~1
|
6.2.11.
Коррекция спектральных изобарных наложений,
коррекция полиатомных наложений, вызванных матрицами образцов,
реагентов и газами плазмы, коррекция транспортных помех
Коррекция трех основных видов помех в традиционном ИСП-МС
анализе с вводом жидкой пробы (без применения динамических реакционных систем),
проводится с использованием трех разных методов, отличающихся между собой как
сложностью, так и надежностью. Выявление помех при отладке методики проводится
путем определения стандартных добавок и измерением серии последовательно
разбавленных проб.
Коррекция изобарных наложений. Примеры коррекции наложений
от изобарных ионов приведены в табл. 9. В
программных пакетах современных масс-спектрометров такие процедуры коррекции
предлагаются автоматически. Точные коэффициенты коррекции определяются
экспериментально.
Таблица 9
Примеры изобарных наложений
|
Определяемый
изотоп
|
Изобарный
ион
|
Корректирующее
выражение
|
|
74Ge
|
74Se
|
-0,1166⋅77Se
|
|
82Se
|
82Kr
|
-
1,0078⋅82Kr
|
|
114Cd
|
114Sn
|
-0,0273⋅114Sn
|
|
120Sn
|
120Те
|
-0,0127⋅120Те
|
|
138Ва
|
138La, 138Се
|
-
0,0009⋅139La; -0,00284⋅140Се
|
Коррекция спектральных наложений от
полиатомных ионов от разных источников требует большего внимания. Для
устранения и коррекции спектральных наложений от полиатомных ионов в ИСП-МС
применяются несколько способов. В скобках приведены элементы, при определении
которых применяется конкретный вариант:
- исключение из процесса пробоподготовки реагентов,
вызывающих спектральные наложения, например, использование азотной кислоты
вместо соляной, которая вызывает образование хлорсодержащих полиатомных ионов
(для V, Cr, As, испытывающих наложения от полиатомных ионов СlO+,
ArCl+);
- удаление компонентов, вызывающих полиатомные наложения,
например, при помощи окисления или упаривания (удаление остаточных количеств
органической матрицы, мешающей определению Cr, Аl, Si из-за
полиатомных ионов ArC+, CN+, СО+);
- учет наложений при помощи эмпирических соотношений для
накладывающихся ионов (например, учет влияния 40Аr35Сl+ на массе 75 по иону 40Аr37As+ на массе
77 при определении As);
- применение десольватирующих устройств для обезвоживания и
высушивания аэрозоля образца перед вводом в плазму (метод требует приобретения
дополнительного оборудования, системы десольватации обладают повышенным
эффектом памяти - требуют более продолжительной отмывки между образцами, метод
устраняет присутствие полиатомных ионов, вызванных только матрицей растворителя
- ArO+, NO+, ArCl+
и т.д.);
- применение электротермической атомизации (ЭТА) или
лазерной абляции (ЛА) для ввода пробы (метод ЭТА хорошо применим для устранения
хлор- и кислородсодержащих помех, однако существенно уступает по себестоимости
и возможностям современному методу коррекции с ОРС; метод ЛА используется для
работы с твердыми гомогенными образцами, трудно поддается калибровке для целей
элементного анализа биологических проб);
- применение дискриминации по энергиям для удаления всех без
исключения полиатомных образований при работе на приборах с октопольной
реакционной системой (метод устраняет влияние полиатомных ионов и улучшает
пределы обнаружения на 1 - 3 десятичных порядка).
Наиболее серьезные помехи от матрицы образцов и от примесей
в плазмообразующем аргоне вызываются полиатомными ионами NN+ и СО+
при анализе кремния. Все три изотопа кремния испытывают наложения, что
уменьшает возможности определения Si в органических матрицах.
Проблемы, связанные с полиатомными ионами, вызванными
матрицей образцов, реагентов и газов плазмы, радикально устраняются при
использовании для измерений приборов с октопольной реакционной системой (ОРС).
В системе ОРС используется дополнительный октополь - ячейка ОРС, расположенная
перед квадруполем масс-анализатора. Влияние полиатомных ионов устраняется путем
дискриминации по энергиям в результате взаимодействий с молекулами нейтрального
газа, напускаемого в ячейку ОРС. В качестве реакционного газа обычно
используется гелий. Таким образом, система ОРС осуществляет эффективную
фильтрацию полиатомных ионов, уменьшает общий фон и увеличивает стабильность
сигналов. Эти особенности ИСП-ОРС-МС приборов позволяют достигать лучших
пределов обнаружения, уверенно определять традиционно трудные элементы для
ИСП-МС определений в органических матрицах, включая Si, Са, Ti, V, Cr, Fe, As,
Se, а также проводить более точный изотопный анализ вещества.
Устранение и учет транспортных помех. Транспортные
помехи возникают из-за различия в вязкости и поверхностном натяжении между
градуировочными стандартами и образцами. Вязкость растворов влияет на
эффективность распыления и, как следствие, воздействует на сигнал каждого
анализируемого изотопа в растворе, в идеале пропорционального его концентрации.
Вязкость водных растворов зависит от концентрации кислоты и от концентрации
матричных компонентов. С использованием довольно высоких факторов разбавления
для образцов с остаточной органической матрицей (1:300 - 1:500) и нормализации
кислотного фона в стандартах, бланках и образцах, влияние транспортных помех
можно уменьшить до незначимого уровня. При работе с меньшими факторами
разбавления (от 1:10 до 1:100 для биологических жидкостей) рекомендуется
убедиться в отсутствии помех, проанализировав серию последовательных
разбавлений одной пробы (например, 1:10, 1:50, 1:100, 1:200) и выбрать
компромиссный фактор разбавления, при котором не страдает чувствительность
определения интересующих элементов. Если транспортные помехи невозможно
устранить, следует применить внутреннюю стандартизацию, добавляя во все
холостые пробы, стандартные растворы и образцы внутреннего стандарта - раствор
Rh или In, чтобы получить их конечную концентрацию во всех растворах 10 мкг/л.
Применение внутренней стандартизации также позволяет компенсировать погрешности
разбавления образцов и учесть многие матричные влияния на плазму и поток ионов.
6.2.12.
Градуировка масс-спектрометра
Калибровку спектрометра выполняют перед началом измерений
полностью подготовленных проб, используя градуировочные растворы по п. 6.2.9 при параметрах, установленных
по п. 6.2.10. Определение
градуировочной зависимости, обработка и хранение результатов калибровки
выполняются программным обеспечением спектрометра. Проверка калибровок
проводится перед началом анализа образцов. Проверка заключается в измерении
стандартного аттестованного образца исследуемой матрицы. Современные программные
пакеты для ИСП-МС систем позволяют задавать критерии допустимого качества
калибровок, основанные на точности и воспроизводимости результатов для
проверочных стандартов, а также на коэффициенте корреляции и программировать
алгоритм автоматических измерений, который может включать повторные проверки
калибровок и перекалибровки без участия оператора.
Для выявления и учета дрейфа чувствительности прибора
повторные измерения проверочных стандартов и/или полные перекалибровки
рекомендуется проводить каждые 1 - 2 ч работы (через каждые 15 - 30 образцов),
в зависимости от стабильности окружающей температуры, питающего напряжения и
других условий в лаборатории.
6.2.13.
Выполнение измерений
Ввод в масс-спектрометр подготовленной пробы, измерение
сигналов изотопов проводят при нормальных климатических условиях испытаний в
соответствии с п. 6.2.6 с учетом
требований руководства (инструкции) по эксплуатации прибора. Устанавливают
оптимальный режим регистрации масс-спектров и измерений в соответствии с
рекомендациями производителя данного прибора. Типичные установки рабочих
параметров при измерениях приведены в табл. 8.
Первичная обработка сигналов и расчет концентраций проводится программным
обеспечением автоматически, на основании параметров используемого метода и
данных проведенной калибровки. Для измерений используются изотопы, наиболее
предпочтительные по совокупности характеристик. Важнейшими из них являются
относительная распространенность, отсутствие или низкий уровень спектральных
полиатомных наложений, достигаемый предел обнаружения.
6.2.14.
Обработка результатов измерений
Аналитические сигналы обрабатываются программным
обеспечением масс-спектрометра на основе построенных калибровочных линейных
регрессий, рассчитанных методом наименьших квадратов, с учетом коррекции фона,
сигнала внутренних стандартов, а также с учетом влияния изобарных и полиатомных
спектральных наложений. Результат определения каждого элемента представляется
как среднее из нескольких (не менее двух) параллельных измерений анализируемого
образца. Обработка результатов измерений проводится в соответствии с ГОСТ
8.207-76. Результаты измерений отображаются на мониторе, распечатываются
и/или сохраняются в виде файла на жестком диске компьютера. Распечатанные
результаты оформляют согласно требуемому протоколу (табл. 4).
6.2.15.
Внутренний оперативный контроль
Контроль погрешности методики производят в соответствии с ГОСТ
Р ИСО 5725-6-94.
Внутренний контроль качества результатов определения микроэлементов
(сходимость, воспроизводимость, точность) осуществляют с целью получения
оперативной информации о качестве анализов и принятия при необходимости
оперативных мер по его повышению. Методика проведения контрольных тестов
совпадает с таковой для метода атомно-эмиссионной спектрофотометрии и
проводится согласно п. 6.1.14
настоящих методических рекомендаций. Допустимая погрешность определений
отдельных элементов представлена в табл. 10.
Таблица 10
Погрешность измерений элементов методом масс-спектрометрии
с индуктивно связанной плазмой
|
Элемент
|
Диапазон
содержаний, мкг/г
|
Относительная
погрешность, %, Р = 0,95
|
Элемент
|
Диапазон
содержаний, мкг/г
|
Относительная
погрешность, %, Р = 0,95
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Al
|
0,001
- 0,100
|
40
|
Ag
|
0,0001
- 0,0100
|
40
|
|
|
0,1
- 1,0
|
20
|
|
0,01
- 0,10
|
20
|
|
|
1
- 20
|
20
|
|
0,1
- 1,0
|
20
|
|
Be
|
0,001
- 0,010
|
40
|
As
|
0,0005
- 0,0050
|
40
|
|
|
0,01
- 0,10
|
20
|
|
0,005
- 0,050
|
30
|
|
|
0,1
- 1,0
|
20
|
|
0,5
- 0,5
|
25
|
|
Fe
|
0,1 - 1,0
|
40
|
Au
|
0,0001 - 0,0100
|
40
|
|
|
1,0 - 10,0
|
20
|
|
0,01 - 0,10
|
20
|
|
|
10 500
|
20
|
|
0,1 - 0,5
|
20
|
|
K
|
1 - 50
|
45
|
Ba
|
0,0001 - 0,0100
|
40
|
|
|
50 - 500
|
20
|
|
0,01 - 0,10
|
20
|
|
|
500 - 5000
|
15
|
|
0,1 - 1,0
|
20
|
|
Cd
|
0,0001 - 0,0010
|
40
|
Bi
|
0,0001 - 0,0010
|
40
|
|
|
0,001 - 0,100
|
20
|
|
0,001 - 0,010
|
30
|
|
|
0,1 - 0,5
|
15
|
|
0,01 - 0,10
|
25
|
|
Са
|
2 - 20
|
50
|
В
|
0,001 - 0,010
|
40
|
|
|
20 - 200
|
40
|
|
0,01 - 1,00
|
20
|
|
|
200 - 2000
|
25
|
|
1 - 10
|
20
|
|
Со
|
0,0001 - 0,0010
|
40
|
Ce
|
0,0001 - 0,0100
|
40
|
|
|
0,001 - 0,010
|
20
|
|
0,01 - 0,10
|
30
|
|
|
0,01 - 0,50
|
15
|
|
0,1 - 0,5
|
25
|
|
Li
|
0,0001 - 0,0010
|
40
|
Hg
|
0,0001 - 0,0100
|
40
|
|
|
0,001 - 0,010
|
30
|
|
0,01 - 0,10
|
20
|
|
|
0,01 - 0,50
|
20
|
|
0,1 - 1,0
|
20
|
|
Mg
|
0,001 - 0,010
|
50
|
Mo
|
0,0001 - 0,0100
|
40
|
|
|
0,01 - 5,00
|
40
|
|
0,01 - 0,10
|
20
|
|
|
5 - 500
|
20
|
|
0,1 - 0,5
|
20
|
|
Mn
|
0,0001 - 0,0010
|
40
|
Pt
|
0,0001 - 0,0010
|
40
|
|
|
0,001 - 0,100
|
20
|
|
0,001 - 0,010
|
20
|
|
|
0,1 - 2,0
|
20
|
|
0,01 - 0,10
|
20
|
|
Cu
|
0,0001 - 0,0100
|
40
|
Sb
|
0,0001 - 0,0100
|
40
|
|
|
0,01 - 5,00
|
20
|
|
0,01 - 0,10
|
30
|
|
|
5 - 50
|
20
|
|
0,1 - 1,0
|
25
|
|
Na
|
1 - 10
|
50
|
Se
|
0,0005 - 0,0050
|
40
|
|
|
10 - 100
|
35
|
|
0,005 - 0,050
|
30
|
|
|
100 - 1000
|
25
|
|
0,05 - 2,00
|
25
|
|
Ni
|
0,0001 - 0,0010
|
40
|
Sn
|
0,0001 - 0,0100
|
40
|
|
|
0,001 - 0,01
|
20
|
|
0,01 - 0,10
|
30
|
|
|
0,01 - 2
|
20
|
|
0,1 - 2,0
|
25
|
|
Pb
|
0,0001 - 0,0010
|
40
|
Sr
|
0,0001 - 0,0100
|
40
|
|
|
0,001 - 0,010
|
20
|
|
0,01 - 0,10
|
20
|
|
|
0,01 - 10,00
|
20
|
|
0,1 - 5,0
|
20
|
|
Ti
|
0,001
- 0,010
|
40
|
Тl
|
003005
- 003050
|
40
|
|
|
0,01
- 1,00
|
25
|
|
0,0005
- 0,0050
|
30
|
|
|
1
- 10
|
20
|
|
0,005
- 0,100
|
25
|
|
Р
|
5
- 50
|
50
|
V
|
0,0005
- 7 - 0,0500
|
40
|
|
|
50
- 500
|
30
|
|
0,05
- 0,50
|
20
|
|
|
500
- 5000
|
25
|
|
0,5
|
20
|
|
Cr
|
0,001
- 0,010
|
40
|
W
|
0,0001
- 0,0100
|
40
|
|
|
0,01
- 1,00
|
30
|
|
0,01
- 0,10
|
30
|
|
|
1
- 10
|
25
|
|
0,1
- 0,5
|
25
|
|
Zn
|
0,001
- 0,010
|
40
|
|
|
|
|
|
0,01
- 0,10
|
20
|
|
|
|
|
|
0,1
- 500,0
|
20
|
|
|
|
Примечание. Пределы определения рассчитаны по стандартной
методике при 98 %-м доверительном интервале, как 3×СКОфона/ES,
где 3 - значение распределения Стьюдента для 98 %-го интервала и семи степеней
свободы, СКОфона - стандартное отклонение фонового сигнала (имп/с),
рассчитанное по восьми репликам чтения, ES - изотопная чувствительность,
выраженная в имп./с⋅мкг⋅дм3.
Настоящая методика устанавливает метод высокоэффективной
жидкостной хроматографии для определения в пищевых продуктах (безалкогольных и
сокосодержащих напитках, нектарах, соках) массовых концентраций фуллерена С60.
Проведение контроля содержания фуллерена С60 необходимо с целью
обеспечения безопасности пищевых продуктов.
Диапазон обнаружений методики составляет от 0,5 мг/дм3
до 500 мг/дм3.
7.1.
Краткая характеристика фуллерена С60
Общепринятое название: фуллерен С60.
CAS номер: 99685-96-8.
Структурная формула: приведена на рис. 1.
Рис. 1. Структура фуллерена С60
Фуллерены - углеродные кластеры с чётным, более 20, количеством
атомов углерода, образующих три связи друг с другом. Атомы в молекулах
фуллеренов расположены на поверхности сферы или сфероида в вершинах гексагонов
и пентагонов. Фуллерены с количеством атомов более 70 (например, С76,
C78, С84) называют высшими фуллеренами.
Фуллерены представляют собой мелкокристаллические порошки
черного цвета, без запаха, практически не растворимы в полярных растворителях,
слабо растворимы в алканах нормального строения, наиболее высокой
растворимостью фуллеренов характеризуются ароматические углеводороды и их
производные.
7.2.
Методика определения фуллерена С60 в безалкогольных и
сокосодержащих напитках, нектарах, соках
методом высокоэффективной жидкостной хроматографии
7.2.1. Основные положения
7.2.1.1. Принцип метода.
Методика основана на определении фуллерена в безалкогольных
и сокосодержащих напитках, нектарах, соках методом обращеннофазной
высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием
диодно-матричного детектора (длина волны 340 нм) после экстракции фуллерена из
образца бромбензолом.
7.2.1.2. Метрологические характеристики методики.
Таблица 11
|
Метрологические
характеристики
|
Концентрация
фуллерена С60 в пробе
|
|
0,5
- 5,0 мг/ дм3
|
5,0
- 50,0 мг/кг дм3
|
50,0
- 500 и более мг/кг дм3*
|
|
Предел повторяемости (r), %
|
29
|
26
|
25
|
|
Предел воспроизводимости (R), %
|
36
|
30
|
29
|
|
Относительная систематическая ошибка
(δ), %
|
16
|
14
|
13
|
|
Полнота извлечения веществ, %
|
не
менее 80 %
|
|
* без учета погрешности разбавления до соответствующего диапазона
|
7.2.2.
Реактивы
|
Ацетонитрил для жидкостной
хроматографии с коэффициентом пропускания на 220 нм не менее 95 % или выше
|
ТУ 6-09-14-2167-84
|
|
Толуол, осч или «для
хроматографии» или
|
ГОСТ 5789-78
|
|
Бромбензол, осч
|
ТУ СОМР 2-021-06
|
|
Фуллерен С60,
содержание основного вещества > 99,8 %, аттестованный на соответствие
стандартному образцу.
|
ТУ 6-09-3774-74
|
7.2.3.
Приборы, аппаратура, посуда
Исследование проводится на системе ВЭЖХ, снабженной колонкой
размером 4,6×150 мм, заполненной С18 фазой с размером гранул 5 мкм,
насосом высокого давления, детектором с диодной матрицей, петлевым инжектором
(или автосемплером) и системой обработки хроматограмм. В качестве примера можно
привести систему Agilent серий 1100 или 1200 с колонкой «ZORBAX С18».
7.2.4.
Используемое вспомогательное оборудование
|
Встряхиватель вибрационный со
скоростью вращения до 3000 об./мин
|
|
|
Центрифуга с числом оборотов не
менее 10000 об./мин
|
|
|
Весы лабораторные общего
назначения с погрешностью ±0,0005 г
|
ГОСТ
24104-2001
|
|
Пробирки одноразовые типа
«Эппендорф», вместимостью 1,5 см3
|
|
|
Колбы мерные К 1-25-1 или К
1-25-2, К 1-50-1 или К 1-50-2, К 1-100-1 или К 1-100-2
|
ГОСТ
1770-74
|
|
Пипетки 4-1-1 или 5-1-1, 4-1-2 или
5-1-2, 4-2-10 или 5-2-10, 4-2-5 или 5-2-5
|
ГОСТ
29227-91
|
|
Виалы (емкость, вместимостью 4 - 6
см3 с герметично завинчивающейся крышкой) с пластиковыми
вставками, вместимостью 0,2 - 0,3 см3.
|
|
|
Виалы используются в том случае,
если для ввода пробы в прибор используется автосемплер
|
|
|
Допускается использование приборов
и посуды с метрологическими характеристиками и реактивов квалификацией не
ниже указанных выше.
|
|
7.2.5.
Отбор проб
Для учета специфики отбора проб отдельных видов продуктов
следует руководствоваться действующей нормативно-технической документацией на
конкретную продукцию.
7.2.6.
Подготовка к определению
7.2.6.1. Приготовление стандартного раствора фуллерена
Навеску 0,0250 ± 0,0001 г кристаллического фуллерена С60
количественно переносят в мерную колбу вместимостью 25 см3,
растворяют в 15 см3 бромбензола, тщательно перемешивают на магнитной
мешалке до полного растворения, доводят бромбензолом до метки (25 см3)
и тщательно перемешивают. Получают основной стандартный раствор в бромбензоле с
массовой долей фуллерена 1 мг/см3. Для получения рабочих стандартных
растворов последовательно разбавляют основной стандартный раствор:
раствор № 1: в мерную колбу вместимостью 25 см3
помещают 2,5 см3 основного раствора и доводят объем до метки
бромбензолом. Получают раствор с концентрацией 100 мкг/см3;
раствор № 2: в мерную колбу вместимостью 50 см3
помещают 1,0 см3 основного раствора и доводят объем до метки
бромбензолом. Получают раствор с концентрацией 20 мкг/см3;
раствор № 3: в мерную колбу вместимостью 100 см3
помещают 0,2 см3 основного раствора и доводят объем до метки
бромбензолом. Получают раствор с концентрацией 2 мкг/см3.
Основной и рабочие стандартные растворы фуллерена хранят в
пластиковой темной посуде с плотно навинчивающейся пробкой в прохладном темном
месте (при температуре около 0 °С). Сроки годности основного раствора - 3
месяца, рабочих растворов - 1 неделя.
7.2.6.2. Подготовка пробы для анализа
0,70 ± 0,01 см3 тщательно перемешанного образца
помещают в пробирку для центрифугирования типа «Эппендорф» и добавляют 0,70 см3
бромбензола. Пробирку плотно закрывают, тщательно встряхивают в течение 10 мин
и центрифугируют 25 мин в интервале оборотов от 4000 до 10000 об./мин. Верхний
слой (водный) отбирают и отбрасывают. Аликвота нижнего слоя (200 - 300 мм3,
Vвкола, бромбензол) переносится в
виалы с пластиковыми вставками. Виалы устанавливаются в отделение автосемплера.
При использовании ручного инжектора аликвотой слоя, содержащего бромбензол,
заполняют петлю инжектора.
В случае высоких концентраций фуллерена аликвоту слоя,
соответствующего бромбензолу, разбавляют бромбензолом.
7.2.7.
Обнаружение и количественное определение фуллерена методом
высокоэффективной жидкостной хроматографии
Образцы анализируют методом ВЭЖХ на жидкостном хроматографе
с насосом высокого давления с подачей растворителя от 0,1 до 5,0 см3/мин,
оборудованном диодноматричным детектором с переменной длиной волны и системой
для сбора и обработки хроматографических данных.
7.2.7.1. Калибровка хроматографа
Для градуировки в хроматограф вводят пробы рабочих
стандартных растворов фуллерена концентрациями 100, 20 и 2 мкг/см3
объемами 4, 10 и 20 мм3 (от 8 до 2000 нг), регистрируют их площади и
времена удерживания на хроматограммах. При использовании ручного инжектора
объем вводимой пробы должен соответствовать объему используемой петли. В этом
случае рабочие растворы дополнительно разбавляют, чтобы получить необходимое
количество точек в указанном интервале.
1.2.12. Условия проведения обращено-фазовой ВЭЖХ
Хроматографическая колонка с силикагелем, химически
связанным с октадецилсиланом (ODS или С18), размер частиц 5 мкм, длина колонки
150 мм, внутренний диаметр колонки 4,6 мм или аналогичная.
Подвижная фаза: ацетонитрил-толуол (45:55, по объему).
Скорость подачи подвижной фазы: 1,0 см3/мин.
Объем вводимой пробы от 1 до 100 мм3.
Коэффициент емкости фуллерена в этих условиях составляет
величину порядка 4,0 (время удерживания от 7,5 до 8,0 мин, при времени выхода
растворителя от 1,8 до 2,0 мин).
Детектирование осуществляют при аналитической длине волны
340 нм (при использовании фотодиодноматричного детектора дополнительным
подтверждением наличия фуллерена является совпадение УФ-спектра анализируемого
вещества в диапазоне от 200 до 400 нм с УФ-спектром фуллерена).
Идентификацию компонентов на хроматограмме осуществляют
путем сравнения со временем удерживания стандарта фуллерена и совпадения
спектральных данных.
Если пик фуллерена в исследуемом растворе выходит за пределы
линейности, хроматографическое разделение проводят повторно после разбавления
исследуемого раствора.

Рис. 2. Пример хроматограммы экстракта фуллерена из
яблочного сока
с мякотью (экстрагент - бромбензол), содержащего фуллерен в концентрации
2 мкг/см3. Ось абсцисс: время, минуты; ось ординат - интенсивность
пика,
милливольты. Пики, вышедшие на 1 - 2 минутах соответствуют бромбензолу.
Пик на 7,6 минуте соответствует фуллерену. Оптическая плотность 340 нм.
7.2.8. Обработка результатов измерения
Содержание фуллеренов в образцах пищевых продуктов
рассчитывают методом абсолютной калибровки.
Стандартный график строят не менее чем по 5 точкам,
рассчитывая его параметры по методу наименьших квадратов (линейная регрессия).
Возможно использование встроенной программы обработки данных для построения
стандартного графика.
Вычисления проводят до третьей значащей цифры. За результат
принимают среднее арифметическое результатов двух параллельных измерений.
7.3.
Оперативный контроль результатов измерений
7.3.1. Проверка приемлемости результатов параллельных
определений
Расхождение между двумя
параллельными определениями (в процентах от среднего значения), выполненных в
одной лаборатории, не должно превышать норматива предела повторяемости (r), приведенного в таблице метрологических характеристик
при вероятности Р = 0,95:
X1, Х2
- результаты параллельных определений, мг/дм3.
При соблюдении этого условия за окончательный результат
испытаний принимают среднее арифметическое значение двух параллельных
определений Хср, округленное до третьей значащей цифры.
7.3.2.
Контроль точности результатов измерений
Периодичность контроля погрешности измерений зависит от
количества рабочих измерений за контролируемый период и определяется планами
контроля.
Образцами контроля являются рабочие пробы пищевых продуктов.
Отбирают пробу и разделяют ее на 2 равные части. Одну из них оставляют без
изменений, а к другой добавляют раствор стандарта фуллерена, такое количество,
чтобы его массовая доля в пробе по сравнению с исходным значением увеличилась
на 50 - 100 %. Добавка должна вводиться в пробу перед началом пробоподготовки.
Обе пробы анализируют в точном соответствии с прописью
методики и получают результаты анализа исходной пробы (С(М))
и пробы с добавкой (Сʹ(М)). Определение проводят в
одинаковых условиях, а именно: анализ проводит один аналитик, с использованием
одного набора мерной посуды, реактивов, растворов и т.д.
Алгоритм проведения оперативного
контроля погрешности с использованием метода добавок состоит в сравнении
результата контрольного определения, равного разности между результатом
контрольного измерения пробы с добавкой (Сʹ(М)), пробы
без добавки (С(М)) и величиной добавки (Сдоб(М))
с нормативом оперативного контроля (К). Решение об удовлетворительной
погрешности принимается при выполнении следующего условия (при Р =
0,95):
|
|Сʹ(М)
- С(М) - Сдоб(М)| ≤ К
|
Норматив оперативного контроля погрешности рассчитывают по
формуле (Р = 0,95):
|
К
= 0,84×(Δ2Сʹ(М) + Δ2С(М))1/2,
где
|
Δ - граница абсолютной погрешности, вычисляемой по
формуле:
(n -
объем выборки, t - критерий Стьюдента для п измерений и Р =
0,95).
При превышении норматива оперативного контроля погрешности
эксперимент повторяют с использованием другой пробы.
При повторном обнаружении превышения норматива эксперимент
прекращают и проводят тщательный анализ исправности оборудования, чистоты
используемых реактивов, посуды, помещения и т.д. с целью выявления факторов,
влияющих на результаты измерений.
7.4.
Требования техники безопасности
При выполнении измерений необходимо соблюдать требования
техники безопасности при работе с химическими реактивами по ГОСТ
12.1.007-76, требования электробезопасности при работе с электроустановками
по ГОСТ
12.1.019-79, требования действующей нормативной документации на правила
безопасной работы с продукцией, содержащей наноматериалы, а также требования,
изложенные в технической документации на используемое оборудование.
7.5.
Требования к квалификации операторов
Работу по указанной методике могут исполнять
высококвалифицированные специалисты в области газожидкостной хроматографии и
санитарной химии, имеющие опыт работы с используемым оборудованием не менее 1
года. Исполнители должны быть проинструктированы об основных мерах техники
безопасности при работе с веществами 1 - 2 класса опасности, органическими
растворителями, а также с основными правилами безопасности при работе в
химической лаборатории.
7.6.
Условия измерений
Помещение лаборатории должно соответствовать санитарным
правилам проектирования, оборудования, эксплуатации и содержания
производственных и лабораторных помещений, предназначенных для проведения работ
с веществами 1 - 2 класса опасности, органическими растворителями.
Аналитическая лаборатория должна быть оснащена вентиляционной системой согласно
ГОСТ
12.4.021-75.
Температура окружающего воздуха должна быть от 15 до 25 °С.
Относительная влажность воздуха не более 80 % при 25 °С. Напряжение
электропитания 220 ± 10 В. Частота переменного тока 50,0 ± 0,2 Гц.
8.1.
Принцип метода
Основным методом идентификации наноматериалов биогенного
происхождения, представляющих собой конструкты на основе рекомбинантной ДНК,
рекомбинантных вирусные и псевдовирусных частиц, как и для традиционных
ДНК-содержащих материалов, является полимеразная цепная реакция (ПЦР).
Идентификация ДНК-содержащих биогенных наноматериалов методом ПЦР позволяет с
высокой специфичностью проводить качественный, а при необходимости и
количественный анализ наличия данных наноматериалов. Для выявления ДНК
биогенных наноматериалов определён ряд праймеров, позволяющих проводить
амплификацию ДНК, содержащейся в составе таких стандартных наноматериалов как
псевдовирусные наночастицы аденовирусов, лентивирусов человека, полимавируса
мыши, вируса гепатита В, рекомбинантных аленоассоциированных вирусов и
псевдобактериофагов М13 и MS2. Праймеры являются специфическими в отношении ДНК
каждого из вышеперечисленных видов наночастиц. В настоящем разделе методических
рекомендаций приведены праймеры и программа проведения амплификации для выявления
псевдоаденовирусных наночастиц, поскольку данный тип псевдовирусных
наночастиц является наиболее распространенным при разработке искусственных
комплексных наноструктур. Для идентификации наночастиц, содержащих
специфические молекулы ДНК (например, зонды) разработка праймеров должна
осуществляться в каждом конкретном случае на основе определения
последовательности ДНК, используемой для создания той или иной наноконструкции.
В основе метода ПЦР лежит многократное копирование
(амплификация) специфического фрагмента ДНК-мишени, который является маркерным
для данного вида исследуемого наноматериала. Такое копирование осуществляется
ферментом термостабильной ДНК-полимеразой в присутствии
дезоксирибонуклеозидтрифосфатов (дНТФ) и синтетических олигонуклеотидных (20 -
25 нп) праймеров - затравок синтеза ДНК. Праймеры комплементарны участкам,
фланкирующим последовательность-мишень на противоположных цепях ДНК. После
отжига (присоединения) праймеров на противоположных цепях ДНК, их 3’-концы
направлены навстречу друг другу. Поскольку синтез новых комплементарных цепей
ДНК инициируется 3’-гидроксильной группой праймера, то синтез ДНК происходит в
границах последовательности, фланкируемой праймерами. В результате происходит
экспоненциальное увеличение числа копий специфического фрагмента по формуле 2n, где n - число
циклов амплификации.
Цикл состоит из трех этапов, каждому из которых
соответствует определенный температурный режим:
- расплетение двойной спирали ДНК (денатурация ДНК)
происходит при температуре +94 °С;
- присоединение (отжиг) праймеров происходит комплементарно
при температуре, специфической для данной пары праймеров;
- синтез новых цепей ДНК протекает при температуре +72 °С
путем удлинения в направлении 5ʹ - 3ʹ конца синтезируемого фрагмента
ДНК.
В результате 30 - 35 циклов амплификации синтезируется
порядка 108 копий фрагмента ДНК, что делает возможным визуальный учет
результатов после проведения электрофореза в агарозном геле.
В положительном контрольном образце ДНК после разделения
продуктов ПЦР в агарозном геле при просмотре в УФ-лучах должна выявляться одна
флуоресцирующая полоса оранжево-красного цвета. Размер фрагмента в исследуемых
положительных образцах должен соответствовать размеру фрагмента положительного
стандартного образца. В отрицательном стандартном образце полоса,
соответствующая по размеру специфическим фрагментам амплифицируемой ДНК, должна
отсутствовать.
8.2.
Приборы и оборудование
|
Программируемый термостат (ДНК-амплификатор)
типа «Терцик МС2» или иные типы амплификаторов, зарегистрированные в
Российской Федерации в установленном порядке
|
|
|
Термостат, поддерживающий
температуру +45 °С, для пробирок объемом 1,5 см3
|
|
|
Центрифуга со скоростью вращения ротора
до 12000 об./мин для пробирок вместимостью 1,5 и 0,5 см3.
|
|
|
Встряхиватель вибрационный типа
«Вортекс» со скоростью вращения до 3000 об./мин
|
|
|
Прибор для горизонтального
электрофореза
|
|
|
Источник постоянного тока
|
|
|
Водяная баня с подогревом до +95
°С или
|
|
|
СВЧ-печь
|
|
|
Ультрафиолетовый трансиллюминатор
|
|
|
Очки или маска защитные
|
ГОСТ
26678-85
|
|
Холодильник бытовой электрический
|
|
|
Морозильная камера, обеспечивающая
температуру (-20) °С или ниже
|
|
|
Гомогенизатор типа «SilentCrusher»
или аналогичный других моделей
|
|
|
Ступка фарфоровая с пестиком
|
ГОСТ
9147-80
|
|
Пинцет медицинский
|
ГОСТ
21241-89
|
|
Ножницы
|
ГОСТ
21239-93
|
|
Скальпель
|
ГОСТ
21240-89
|
|
Весы лабораторные общего
назначения 2-го класса точности
|
ГОСТ
24104-2001
|
|
Мембранные установки для получения
деионизованной воды
|
ОСТ 11-029.003-80
|
|
Анализатор потенциометрический,
погрешность измерений pH ± 0,01
|
ГОСТ
27987-88
|
|
Облучатель бактерицидный настенный
ОБН-150
|
ТУ 954-001-0492102-01
|
|
Дозаторы с переменным объёмом
дозирования «Gilson»:
|
|
|
- 0,2 - 2,0 мм3 с шагом
0,01 мм3, с точностью ±1,2 %;
|
|
|
- 2 - 20 мм3 с шагом
0,01 мм3, с точностью ±0,8 %;
|
|
|
- 1 - 10 см3 с шагом
0,1 см3, с точностью ±0,5 %
|
|
|
Дозаторы «Ленпипет»:
|
ТУ 9452-002-33189998-2002
|
|
- 0,5 - 10,0 мм3 с
шагом 0,01 мм3, с точностью ±0,8 %;
|
|
|
- 20 - 200 мм3 с шагом
0,1 мм3, с точностью ±0,6 %;
|
|
|
- 100 - 1000 мм3 с
шагом 1 мм3, с точностью ±3 %
|
|
|
Пробирки типа «Эппендорф»
вместимостью 1,5 см3
|
|
|
Пробирки типа «Эппендорф» для ПЦР
вместимостью 0,5 см3
|
|
|
Наконечники пластиковые объемом 1
- 200 мм3
|
|
|
Наконечники пластиковые объемом
200 - 1000 мм3
|
|
|
Перчатки резиновые
|
ГОСТ
3-88
|
|
Колбы плоскодонные конические
разной вместимости
|
ГОСТ
1770-74
|
|
Цилиндры стеклянные мерные
лабораторные вместимостью 25, 100, 1000 см3
|
ГОСТ
1770-74
|
|
Воронки стеклянные
|
ГОСТ
25336-82
|
|
Штативы для пробирок объемом 1,5
см3
|
|
8.3. Материалы и
реактивы
|
Комплект № 1А для выделения ДНК из
воздуха, воды и пищевых продуктов, таких как ферментные препараты, стартерные
и заквасочные культуры, БАД к пище
|
ТУ 9398-001-01897357-2008
|
|
Комплект № 1Б набора «ГМ-БАКТ1»
для выделения ДНК из организма беспозвоночных и позвоночных животных,
растений и пищевых продуктов
|
ТУ 9398-001 -01897357-2008
|
|
Трис-HCl фирмы «Sigma», США или
аналогичный
|
|
|
Тритон Х-100 фирмы «Merck»,
Германия или аналогичный
|
|
|
Гуанидина гидрохлорид фирмы
«Сигма», США или аналогичный
|
|
|
ЭДТА (этилендиаминтетрауксусная
кислота)
|
ГОСТ
10652-73
|
|
Додецилсульфат натрия
|
ТУ 6-09-64-75
|
|
Суспензия диоксида кремния фирмы
«Sigma», США или аналогичная
|
|
|
Фенол водонасыщенный
|
ГОСТ
23519-93
|
|
Хлороформ водонасыщенный
|
ГОСТ 20015-88
|
|
Спирт этиловый ректифицированный
|
ГОСТ
Р 51652-2000
|
|
Ацетат аммония
|
ГОСТ
3117-78
|
|
Протеиназа К, активность > 30
ед./мг, фирмы «Promega», США или аналогичная
|
|
|
Магний хлористый 25 мМ водный
раствор фирмы «Promega», США или аналогичный
|
ГОСТ 4568-95
|
|
Калий хлористый
|
|
|
Водный раствор
дезоксинуклеотидтрифосфатов (дНТФ) (0,1 М) фирмы «Promega», США или
аналогичный
|
|
|
Креозоловый красный, чда
|
ТУ 6-09-071670-88
|
|
Термостабильная ДНК-полимераза
фирмы «Promega», США или аналогичная
|
|
|
Масло вазелиновое
|
ГОСТ 3164-78
|
|
Трис-ацетат фирмы «Sigma», США или
аналогичный
|
|
|
Ледяная уксусная кислота
|
ГОСТ 61-75
|
|
Агароза для электрофореза фирмы
«Sigma», США или аналогичная
|
|
|
Бромистый этидий фирмы «Sigma»,
США или аналогичный
|
|
|
Вода деионизованная
|
ОСТ 11-029.003-80
|
Допускаются к использованию
тест-системы, комплекты реагентов и материалы аналогичного назначения других
изготовителей, разрешенные к применению в установленном порядке и с
характеристиками, обеспечивающими проведение исследований в соответствии с
данным документом.
8.4.
Стандартные образцы наноматериалов,
применяемые при калибровке метода
При калибровке метода используется стандартный образец
псевдо-аденовирусных наночастиц, производства НИИ эпидемиологии и микробиологии
им. Н.Ф. Гамалеи РАМН (Россия).
8.5.
Методика пробоподготовки
Для выделения ДНК из образцов рекомендуется использовать
комплекты для выделения ДНК № 1А и № 1Б наборов «ГМ-БАКТ-1», производства НИИ
эпидемиологии и микробиологии им. Н.Ф. Гамалея РАМН, или тест-системы,
комплекты реагентов и материалы аналогичного назначения других изготовителей,
разрешенные к применению в установленном порядке и с характеристиками,
обеспечивающими проведение исследований в соответствии с данными методическими
рекомендациями.
В качестве материала для проведения пробоподготовки
комплектом № 1А используют образцы пищевых продуктов, в том числе ферментных препаратов,
стартерных и заквасочных культур, БАД к пище. В качестве материала для
проведения пробоподготовки комплектом № 1Б используют образцы, взятые из
организмов беспозвоночных и позвоночных животных, растений и пищевых продуктов.
Из отобранных проб 0,5 г каждого образца гомогенизируют при помощи тефлонового
пестика в 0,5 см3 стерильной деионизованной воды. Подготовленные
образцы следует использовать для анализа в тот же день. Допускается хранение
образцов при температуре -20 °С не более 2 недель.
8.5.1.
Выделение ДНК из образцов комплектом № 1А
8.5.1.1. Исследуемый материал центрифугируют в течение 10
мин при комнатной температуре 18 - 25 °С при 12000 об./мин. Удаляют
приблизительно 600 мм3 надосадочной жидкости. Оставшийся материал
(примерно 100 - 110 мм3) тщательно перемешивают в пробирке на
вортексе и добавляют к суспензии 300 мм3 раствора 1, входящего в
комплект набора, и 5 мм3 суспензии двуокиси кремния. Пробы
инкубируют в течение 15 мин при комнатной температуре, периодически перемешивая
на вортексе.
8.5.1.2. Пробы центрифугируют в течение 30 с, при комнатной
температуре при 12000 об./мин. Супернатант удаляют.
8.5.1.3. К осадку добавляют 150 мм3 раствора 2,
встряхивают его на вортексе и центрифугируют в течение 30 с при комнатной
температуре при 12000 об./мин. Супернатант удаляют.
8.5.1.4. К осадку добавляют 700 мм3 раствора 3,
встряхивают его на вортексе и центрифугируют в течение 30 с при комнатной
температуре при 12000 об./мин. Супернатант удаляют. Данную процедуру отмывки
повторяют два раза.
8.5.1.5. Дополнительным центрифугированием с последующим
удалением супернатанта убирают остатки раствора 3. Пробы подсушивают в течение
5 мин при температуре +45 °С, оставляя пробирки открытыми.
8.5.1.6. Добавляют в каждую пробирку 50 мм3
деионизованной воды, перемешивают на вортексе и инкубируют в течение 5 мин при
температуре +45 °С.
8.5.1.7. Пробы центрифугируют при комнатной температуре в
течение 30 с при 12000 об./мин, водную фазу отбирают в другую пробирку и
используют в качестве исследуемого образца ДНК для постановки реакции
амплификации, либо хранят при температуре -20 °С не более двух недель.
8.5.2.
Выделение ДНК из образцов комплектом № 1Б
8.5.2.1. Раствор 1, входящий в комплект набора, прогреть при
температуре +25 °С до полного растворения осадка. Непосредственно перед
применением к раствору 1 добавить протеиназу К до концентрации 200 мкг/см3
(0,001 г на 5,0 см3).
8.5.2.2. В полипропиленовую пробирку вместимостью 1,5 см3
внести 100 мм3 гомогенизированного образца, добавить 100 мм3
раствора 1. Перемешать на вихревом смесителе в течение 3 - 5 с.
8.5.2.3. Пробирки инкубировать при температуре +55 °С в
течение 40 мин.
8.5.2.4. Добавить 200 мм3 (равный объем) раствора
2, перемешать на вихревом смесителе в течение 10 с и центрифугировать при
комнатной температуре (18 - 25 °С) в течение 5 мин при 10000 - 12000 об./мин
(10000 - 13000 g).
8.5.2.5. Отобрать верхнюю (водную) фазу и внести ее в
полипропиленовую пробирку вместимостью 1,5 см3. В эту пробирку
добавить 200 мм3 (равный объем) раствора 3.
8.5.2.6. Перемешать на вихревом смесителе в течение 3 - 5 с
и центрифугировать при комнатной температуре в течение 2 мин при 10000 - 13000
g.
8.5.2.7. Отобрать водную фазу (около 200 мм3) и
внести ее в полипропиленовую пробирку вместимостью 1,5 см3. В эту
пробирку добавить 40 мм3 раствора 4 и 720 мм3 (3 объема)
раствора 5. Перемешать на вихревом смесителе в течение 3 - 5 с.
8.5.2.8. Инкубировать при комнатной температуре в течение 40
мин.
8.5.2.9. Центрифугировать при комнатной температуре (18 - 25
°С) в течение 15 мин при 12000 об./мин (13000 g).
8.5.2.10. Супернатант удалить. В пробирку внести 100 мм3
раствора 6.
8.5.2.11. Центрифугировать в течение 1 мин при комнатной
температуре при 12000 об./мин (13000 g).
8.5.2.12. Супернатант удалить. Осадок подсушить на воздухе в
течение 10 мин.
8.5.2.13. Растворить осадок в 50 мм3 раствора 7.
Полученные образцы ДНК использовать для дальнейшего ПЦР-анализа.
8.6.
Методика проведения анализа
Праймеры на выявление ДНК псевдоаденовирусной наночастицы
были выбраны на основе анализа ДНК аденовируса человека 5-го серотипа с помощью
компьютерной программы «OLIGO 4.0» в пределах последовательности гена основного
белка капсида аденовируса - гексона.
Праймер Ad5-for-5’-act-aca-aca-ttg-gct-acc-agg-3’ расположен
на 21159-21179 нуклеотидах ДНК Ад5, праймер
Ad5-rev-5’-caa-aac-ata-aag-aag-ggt-ggg-c-3’ расположен на 21598-21577
нуклеотидах ДНК Ад5. Получаемый в результате ПЦР фрагмент ДНК содержит 418
нуклеотидов.
Перед началом работы вынуть из морозильной камеры комплект
реагентов для амплификации (ПЦР-буфер, праймеры, деионизованную воду, фермент
Taq-полимеразу и вазелиновое масло). Разморозить содержимое пробирок при
комнатной температуре, тщательно перемешать на вихревом смесителе в течение 10
с и поместить все пробирки в холодильник.
Промаркировать соответствующим образом амплификационные
пробирки вместимостью 0,2 (или 0,5) см3 для анализируемых образцов,
а также 2 амплификационные пробирки: ПК (положительный контрольный образец ДНК)
и ОК (отрицательный контрольный образец).
Полимеразную цепную реакцию проводят в суммарном объеме 30
мм3. Для проведения анализа одного образца в пробирку объемом 0,5 см3
вносят следующие компоненты в указанном порядке (табл. 12):
Таблица 12
|
Вода
деионизированная
|
17,5
мм3
|
|
10-кратный ПЦР-буфер, состоящий из
трис-НСl, 120 мМ; KCl, 600 мМ; MgCl2, 18 мМ;
|
3,0
мм3
|
|
Водный раствор дНТФ 3,0 мМ
|
3,0
мм3
|
|
Водный раствор праймеров 20 пмоль/мм3
|
3,0
мм3
|
|
Taq-полимераза 5 ед./мм3
|
0,5
мм3
|
Примечание. При анализе N образцов рабочий раствор готовится в
количестве, необходимом для анализа N + 1 образцов.
В каждую пробирку с анализируемыми образцами и в пробирки ПК
и ОК внести по 27 мм3 рабочего раствора.
В каждую пробирку добавить по 1 капле (около 20 мм3)
вазелинового минерального масла.
В каждую пробирку с анализируемыми образцами внести под
масло по 3,0 мм3 исследуемой ДНК и закрыть их.
В пробирку, маркированную ОК, внести под масло 3,0 мм3
отрицательного контрольного образца и закрыть ее.
В пробирку, маркированную ПК, внести под масло 3,0 мм3
положительного контрольного образца ДНК и закрыть ее.
Содержимое пробирок осторожно перемешать и центрифугировать
при комнатной температуре (18 - 25 °С) в течение 5 с при 10000 об./мин (11000
g).
Примечание. Во избежание контаминации следует вносить образцы ДНК
наконечниками с аэрозольным барьером.
Установить все пробирки в блок
амплификатора и провести амплификацию с учетом объема реакционной смеси,
равного 30 мм3 (табл. 13).
Таблица 13
Режим амплификации
|
п/п
|
Температура,
°С
|
Время
|
Количество
повторов
|
|
1
|
95
|
10
мин
|
1
раз
|
|
2
|
94
|
30
с
|
|
|
|
56
|
30
с
|
30
раз
|
|
|
72
|
30
с
|
|
|
3
|
72
|
5
мин
|
1
раз
|
|
4
|
10
|
Хранение
|
|
8.7.
Анализ амплифицированной ДНК
Результаты ПЦР регистрируют методом электрофореза в 1,2 %-м
агарозном геле, приготовленном на 1-кратном трис-ацетатном (1×ТАЕ)
буфере.
Приготовление 1×ТАЕ буфера: 20 см3
50-кратного концентрированного ТАЕ буфера вносят в мерную колбу вместимостью
1000 см3, доводят до метки дистиллированной водой и тщательно
перемешивают.
Приготовление 1,2 %-го агарозного геля: 0,6 г агарозы
растворяют в 50 см3 1×ТАЕ буфера нагреванием в кипящей водяной
бане до полного и равномерного растворения; полученный раствор охлаждают до
температуры 60 °С, добавляют 6 мм3 1 %-го раствора бромистого этидия
и перемешивают.
Внимание: бромистый этидий является сильным мутагеном,
поэтому все манипуляции с ним и с содержащим его агарозным гелем необходимо
выполнять в перчатках!
Проведение
электрофореза:
- полученный раствор заливают в кювету для заливки геля
согласно инструкции к прибору для горизонтального электрофореза. Для создания
стартовых лунок в кювету помещают гребенку с зубцами. Формирование геля агарозы
происходит при температуре ниже +42 °С в течение 10 - 20 мин;
- после застывания агарозы осторожно вынимают гребенку и
переносят гель в камеру для проведения электрофореза. В камеру заливают
1×ТАЕ буфер так, чтобы толщина слоя жидкости над гелем составляла
приблизительно 5 мм;
- вносят в лунки агарозного геля по 12,5 мм3
амплифицированных образцов, подключают к камере источник постоянного тока и
проводят электрофорез при напряжении 120 В в течение примерно 30 мин, помещая
стартовые лунки ближе к катоду;
- вынимают гель из камеры, переносят его на стекло
трансиллюминатора, включают трансиллюминатор и просматривают гель.
8.8.
Представление результатов
8.8.1. Интерпретация результатов анализа
В положительном контрольном образце ДНК должна выявляться
полоса красно-оранжевого цвета, соответствующая по размеру специфическим
фрагментам селективных маркеров.
В отрицательном контрольном образце полоса красно-оранжевого
цвета должна отсутствовать.
Наличие в анализируемом образце полосы красно-оранжевого
цвета, располагающейся точно на уровне полосы положительного контрольного
образца ДНК, свидетельствует о наличии в исследуемом образце соответствующего
селективного маркерного гена. При отсутствии такой полосы результат следует
считать отрицательным.
Наличие полосы красно-оранжевого цвета в отрицательном
контрольном образце, располагающейся на уровне полосы положительного
контрольного образца ДНК, следует рассматривать как результат контаминации.
Полученные результаты желательно документировать
фотографированием гелей с использованием оранжевого светофильтра или с помощью
системы видеодетекции.
8.8.2.
Записи результатов исследования
В организации, проводящей исследования наноматериалов
биогенного происхождения, должны сохраняться все исходные данные, результаты измерений
и наблюдений, вычислений и преобразования данных, записи о калибровке
оборудования, отчеты (в том числе промежуточные), а также другие материалы и
документы, имеющие непосредственное отношение к данному исследованию.
Данные, образцы, навески и т.д. должны иметь индивидуальный
шифр, позволяющий однозначно идентифицировать исследование, использовавшийся
тест, метод, вид исследования, биологическую систему и ссылку на сотрудников
лаборатории, принимавших участие в получении данных или образцов, в подготовке
или проведении исследования.
Первичные данные, полученные в ходе исследования, должны
быть немедленно зарегистрированы, подписаны и датированы, не допускается их
уничтожение, подмена или перезапись. Данные на электронных носителях
обязательно дублируются в бумажном варианте. Исправления первичных данных
оформляются в виде дополнений, которые подписываются и датируются
ответственными исполнителями с указанием причин ошибок.
Список использованных сокращений
ВЭЖХ - высокоэффективная жидкостная хроматография
дНТФ - дезоксинуклеотидтрифосфаты
ДРС - динамическая реакционная система
ИСП-МС - масс-спектрометрия с индуктивно связанной плазмой
МС - масс-спектрометрия
ПЗС - прибор (детектор) с зарядовой связью
ПЭМ, ТЕМ - просвечивающая электронная микроскопия
ПЦР - полимеразная цепная реакция
СВЧ - нагреватель сверхвысокой частоты
СПХЭЭ - спектроскопия характеристических потерь энергии
электронов
УФ - ультрафиолетовое излучение
ХПЭЭ - характеристические потери энергии электронов
ЭМ - электронная микроскопия
DDSA - додецилянтарный ангидрид
DMP - тридиметиламинофенол
MNA - метилэндиковый ангидрид
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)




