Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
1.2.
ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Оценка воздействия наноматериалов
на функцию иммунитета
Методические рекомендации
MP 1.2.0052-11
Москва
2012
1. Разработаны: Федеральной службой по надзору в сфере
защиты прав потребителей и благополучия человека (Г.Г. Онищенко); Учреждением
Российской академии медицинских наук Научно-исследовательским институтом
питания РАМН (В.А. Тутельян, И.В. Гмошинский, С.А. Хотимченко, М.М. Гаппаров,
В.В. Бессонов, Д.Б. Никитюк, Э.Н. Трушина, О.К. Мустафина, О.И. Передеряев,
Е.А. Арианова, О.Н. Тананова, A.А. Шумакова, Р.В. Распопов, В.А. Шипелин);
Федеральным бюджетным учреждением науки «Государственный научный центр прикладной
микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты
прав потребителей и благополучия человека (И.А. Дятлов, B.П. Холоденко, В.В.
Фирстова, В.Д. Потапов, О.В. Полежаева, Е.В. Зырина, П.А. Шрамко); Учреждением
Российской академии наук Институтом биохимии им. А.Н. Баха РАН (В.О. Попов,
Б.Б. Дзантиев, А.В. Жердев); Учреждением Российской академии наук Центром
«Биоинженерия» РАН (К.Г. Скрябин) в рамках Федеральной целевой программы
«Развитие инфраструктуры наноиндустрии в Российской Федерации на 2008 - 2011
годы».
2. Утверждены Руководителем Федеральной службы по надзору в
сфере защиты прав потребителей и благополучия человека, Главным государственным
санитарным врачом Российской Федерации Г.Г. Онищенко 29 декабря 2011 г.
3. Введены в действие 29 декабря 2011 г.
4. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ
Руководитель
Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный
врач Российской Федерации
_____________________
Г.Г. Онищенко
27
декабря 2011 г.
Дата
введения: с момента утверждения
|
1.2.
ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Оценка воздействия наноматериалов
на функцию иммунитета
Методические рекомендации
МР 1.2.0052-11
1.1. Настоящие методические рекомендации определяют порядок
и методы оценки безопасности искусственных наноматериалов по их воздействию на
функцию иммунитета.
1.2. Настоящие методические рекомендации могут применяться:
- при оценке безопасности разрабатываемых новых и уже
используемых наноматериалов;
- при оценке рисков, связанных с процессами производства,
оборота, использования и утилизации наноматериалов;
- в процессе проведения экспертизы продукции сельского
хозяйства, фармацевтической промышленности, биотехнологического производства,
пищевых продуктов, содержащих наночастицы и наноматериалы;
- при проведении мероприятий по осуществлению надзора
(контроля) в процессе производства, переработки и утилизации искусственных
наноматериалов.
1.3. Методические рекомендации разработаны с целью
обеспечения единства измерений и представления результатов при оценке
воздействия наноматериалов на функцию иммунитета.
1.4. Методические рекомендации предназначены для
специалистов органов и организаций Федеральной службы по надзору в сфере защиты
прав потребителей и благополучия человека, а также могут быть использованы
научно-исследовательскими организациями гигиенического профиля, медицинскими
учебными заведениями и иными организациями и учреждениями, проводящими
исследования по оценке безопасности наноматериалов и продукции наноиндустрии.
В связи с расширением использования нанотехнологий в
различных отраслях промышленности, наночастицы и наноматериалы могут
содержаться в значимых количествах в объектах окружающей среды (атмосферный
воздух, вода, почва), продовольственном сырье и пищевых продуктах. Ввиду этого,
оценка риска, связанного с их воздействием на организм, представляет собой
важную задачу, решаемую в ходе осуществления санитарно-эпидемиологического
надзора.
Одним из важнейших этапов оценки риска является
характеристика опасности, то есть количественное определение степени
воздействия опасного фактора (в данном случае наноматериалов) на наиболее
чувствительные органы и системы. В их числе, согласно имеющимся в настоящее
время данным, одно из ведущих мест принадлежит иммунной системе. Это связано,
во-первых, с тем, что клетки иммунной системы принадлежат к числу наиболее
быстро дифференцируемых и обновляемых клеток организма, в них с высокой
эффективностью протекают процессы митоза, биосинтеза ДНК и других биополимеров.
Ввиду наличия у наночастиц многих типов способности проникать через
биологические мембраны в клетки и взаимодействовать с биополимерами, нормальная
функция иммунных клеток должна рассматриваться как одна из наиболее
чувствительных к повреждающему действию этих факторов. Аналогией повреждающего
действия наноматериалов на генетический аппарат клетки и биосинтетические
процессы является в данном случае действие ионизирующей радиации, как известно,
повреждающей также, в первую очередь, клетки иммунной системы.
В рамках Федеральной целевой программы «Развитие
инфраструктуры наноиндустрии на 2008 - 2011 гг.» был разработан и утвержден в
установленном порядке Федеральной службой по надзору в сфере защиты прав
потребителей и благополучия человека ряд методических документов, включающих
порядок и методы тестирования эффектов наночастиц и наноматериалов в
биологических системах различного уровня организации (МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов»;
МУ
1.2.2634-10 «Микробиологическая и молекулярно-генетическая оценка
воздействия наноматериалов на представителей микробиоценоза»; МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов»; МУ
1.2.2741-10 «Порядок отбора проб для выявления и идентификации
наноматериалов в лабораторных животных»; МУ 1.2.2745-10 «Порядок отбора проб
для характеристики действия наноматериалов на лабораторных животных»; МУ
1.2.2869-11 «Порядок оценки токсического действия наноматериалов на
лабораторных животных»; МУ 1.2.2874-11 «Порядок выявления и идентификации
наноматериалов в лабораторных животных»; МР
1.2.2522-09 «Выявление наноматериалов, представляющих потенциальную
опасность для здоровья человека»; МР
1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в
модельных системах in vivo»). Рассматриваемый комплекс методик позволяет
проводить оценку безопасности наночастиц и наноматериалов на иерархически
организованной системе биологических объектов in vitro и in vivo,
включая культуры микроорганизмов, клеточные культуры, гидробионты
(беспозвоночные и рыбы), высшие растения, организмы лабораторных животных с
использованием комплекса морфологических, биохимических, токсикологических,
микробиологических, физиологических и иных методов. Вместе с тем, вопрос об
учёте в рамках указанной методологии воздействия наночастиц и наноматериалов на
функцию иммунитета сохраняет свою актуальность.
В настоящих методических рекомендациях представлены
методические подходы к оценке воздействия наночастиц и наноматериалов, в первую
очередь, на клеточное звено иммунитета (пролиферация иммунокомпетентных клеток,
их функциональные характеристики), а также на гуморальное звено иммунитета,
оцениваемое по продукции специфических антител. Изучение перечисленных
показателей осуществляется на модели экспериментальных животных, которым
вводили наноматериалы принципиально в двух возможных режимах: a) in vivo,
когда количественно оцениваются параметры системы иммунитета непосредствено в
организме экспонированных лабораторных животных и б) ex vivo, когда
лабораторные тесты проводятся в строго контролируемых условиях, в культурах
клеток, полученных от животных, которым предварительно вводили наноматериалы по
определённой схеме. В качестве экспериментальных моделей предлагается
использование как предварительно иммунизированных посторонним (по отношению к тестируемым
наноматериалам) антигеном, так и не иммунизированных животных.
III. Нормативные ссылки
3.1. Федеральный закон от 30 марта 1999 г. № 52-ФЗ
«О санитарно-эпидемиологическом благополучии населения».
3.2. Федеральный закон от 2 января 2000 г. № 29-ФЗ
«О качестве и безопасности пищевых продуктов».
3.3. Федеральный закон от 26 июня 2008 г. № 102-ФЗ
«Об обеспечении единства измерений».
3.4. Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О
техническом регулировании».
3.5. Федеральный закон от 10 января 2002 г. № 7-ФЗ «Об охране
окружающей среды».
3.6. Постановление Правительства Российской Федерации от 30
июня 2004 г. № 322 «Об утверждении Положения о Федеральной службе в сфере
защиты прав потребителей и благополучия человека».
3.7. Постановление Правительства Российской Федерации от 21
декабря 2000 г. № 987 «О государственном надзоре и контроле в области
обеспечения качества и безопасности пищевых продуктов».
3.8. Постановление Правительства Российской Федерации от 21
декабря 2000 г. № 988 «О государственной регистрации новых пищевых продуктов,
материалов и изделий».
3.9. Постановление Правительства Российской Федерации от 2
февраля 2006 г. № 60 «Об
утверждении Положения о проведении социально-гигиенического мониторинга».
3.10. Постановление Правительства Российской Федерации от 15
сентября 2005 г. № 569 «О Положении об осуществлении государственного
санитарно-эпидемиологического надзора в Российской Федерации».
3.11. Приказ Министерства здравоохранения СССР от 12 августа
1977 г. № 755 «О мерах по дальнейшему совершенствованию организационных форм
работы с использованием экспериментальных животных».
3.12. Приказ Министерства здравоохранения и социального
развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении
Правил лабораторной практики».
3.13. Постановление Главного государственного санитарного
врача Российской Федерации от 23 июля 2007 г. № 54 «О надзоре за продукцией,
полученной с использованием нанотехнологий и содержащей наноматериалы».
3.14. Постановление Главного государственного санитарного
врача Российской Федерации от 31 октября 2007 г. № 79 «Об утверждении Концепции
токсикологических исследований, методологии оценки риска, методов идентификации
и количественного определения наноматериалов».
3.15. СП
2.2.2.1327-03 «Гигиенические требования к организации технологических
процессов, производственному оборудованию и рабочему инструменту».
3.16. МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
3.17. МУ
1.2.2636-10 «Проведение санитарно-эпидемиологической экспертизы продукции,
полученной с использованием нанотехнологий и наноматериалов».
3.18. МУ
1.2.2741-10 «Порядок отбора проб для выявления и идентификации
наноматериалов в лабораторных животных».
3.19. МУ 1.2.2745-10 «Порядок отбора проб для характеристики
действия наноматериалов на лабораторных животных».
3.20. МУ 1.2.2874-11 «Порядок выявления и идентификации
наноматериалов в лабораторных животных».
3.21. МУ
1.2.2634-10 «Микробиологическая и молекулярно-генетическая оценка
воздействия наноматериалов на представителей микробиоценоза».
3.22. МУ 1.2.2635-10 «Медико-биологическая оценка
безопасности наноматериалов».
3.23. МУ
1.2.2869-11 «Порядок оценки токсического действия наноматериалов на
лабораторных животных».
3.24. МУК
4.2.2429-08 «Метод определения стафилококковых энтеротоксинов в пищевых
продуктах».
3.25. МР
1.2.2522-09 «Выявление наноматериалов, представляющих потенциальную
опасность для здоровья человека».
3.26. МР
1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в
модельных системах in vivo».
3.27. МР
1.2.0022-11 «Порядок отбора проб для контроля за наноматериалами».
3.28. МР
1.2.0023-11 «Контроль наноматериалов в пищевой продукции».
3.29. МР
1.2.0024-11 «Контроль наноматериалов, применяемых в химической
промышленности».
3.30. МР
1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах
окружающей среды, живых организмах и пищевых продуктах».
3.31. ГОСТ
25336-82 «Посуда и оборудование лабораторные стеклянные. Типы, основные
параметры и размеры».
3.32. ГОСТ
26678-85 «Холодильники и морозильники бытовые электрические компрессионные
параметрического ряда. Общие технические условия».
3.33. ГОСТ
Р 51652-2000 «Спирт этиловый ректификованный из пищевого сырья. Технические
условия».
3.34. ГОСТ
24104-2001 «Весы лабораторные. Общие технические требования».
3.35. ГОСТ
1770-74 «Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы,
пробирки. Общие технические условия».
3.36. ГОСТ
27987-88 «Анализаторы жидкости потенциометрические ГСП. Общие технические
условия».
3.37. ГОСТ 24861-91
«Шприцы инъекционные однократного применения».
3.38. ГОСТ
3-88 «Перчатки хирургические резиновые. Технические условия».
3.39. ГОСТ
4328-77 «Реактивы. Натрия гидроокись. Технические условия».
3.40. ГОСТ
4198-75 «Реактивы. Калий фосфорнокислый однозамещенный. Технические
условия».
3.41. ГОСТ
4233-77 «Реактивы. Натрий хлористый. Технические условия».
3.42. ГОСТ
4172-76 «Реактивы. Натрий фосфорнокислый двузамещенный 12-водный.
Технические условия».
3.43. ГОСТ
25336-82 «Посуда и оборудование лабораторные стеклянные. Типы, основные
параметры и размеры».
3.44. ГОСТ 6709-72
«Вода дистиллированная. Технические условия».
3.45. ГОСТ
2493-75 «Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические
условия».
3.46. ГОСТ 4204-77
«Реактивы. Кислота серная. Технические условия».
3.47. ГОСТ
4201-79 «Натрий углекислый кислый. Технические условия».
3.48. ГОСТ 11293-89 «Желатин.
Технические условия».
3.49. ГОСТ
908-2004 «Кислота лимонная моногидрат пищевая. Технические условия».
3.50. ГОСТ
22280-76 «Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия».
3.51. ГОСТ
3773-72 «Реактивы. Аммоний хлористый. Технические условия».
3.52. ГОСТ
245-75 «Реактивы. Натрий фосфорнокислый однозамещенный 2-водный.
Технические условия».
3.53. ГОСТ 2263-79
«Натр едкий технический».
3.54. ГОСТ
3118-77 «Реактивы. Кислота соляная. Технические условия».
3.55. ГОСТ
17299-78 «Спирт этиловый технический. Технические условия».
3.56. ГОСТ
7.32-2001 «Отчет о научно-исследовательской работе. Структура и правила
оформления».
3.57. ГОСТ
Р ИСО/МЭК 17025-2006 «Общие требования к компетентности испытательных и
калибровочных лабораторий».
4.1. Целью оценки воздействия наноматериалов искусственного
происхождения на функцию иммунитета является:
- выявление процессов иммунной защиты организма, являющихся
мишенями токсического действия наночастиц и наноматериалов;
- установление зависимости доза-эффект, возможных эффектов
кумуляции наночастиц в организмах животных по показателям воздействия на
функцию иммунитета;
- токсиколого-гигиеническая и медико-биологическая оценка
безопасности наноматериалов и продукции, их содержащей;
- гигиеническое нормирование содержания наноматериалов в
объектах окружающей среды и потребительской продукции;
- экспертиза наночастиц и наноматериалов, производимых на
территории Российской Федерации или ввозимых на территорию Российской
Федерации;
- оценка риска для здоровья населения при поступлении
наноматериалов в организм с пищей, водой, атмосферным воздухом и иными путями;
- разработка мероприятий по охране здоровья населения и
окружающей среды от воздействия наночастиц и наноматериалов.
4.2. Оценка воздействия наноматериалов на показатели системы
иммунитета проводится в экспериментах in vivo, при путях поступления
наночастиц и наноматериалов, максимально приближенных к условиям экспонирования
ими через объекты окружающей среды в обстановке реального воздействия, а также
в системах ex vivo, включающих тестирование в культуре клеток,
полученных от животных, которым вводили наноматериалы.
4.3. Объектами оценки воздействия наноматериалов на систему
иммунитета являются состав и численная характеристика популяций и субпопуляций
иммунокомпетентных клеток, их функциональные характеристики в базальных
условиях и при антигенной и неспецифической стимуляции, показатели апоптоза,
уровни гуморальных факторов иммунитета (цитокинов, антител).
4.4. Выбор биологического объекта воздействия наночастиц и
наноматериалов (вида, линии лабораторных животных), принципы выбора действующих
доз, пути, длительность и кратность введения наночастиц и наноматериалов,
состав опытных и контрольных групп тестируемых организмов устанавливаются для
отдельных тест-систем в соответствии с МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов»,
МР
1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в
модельных системах in vivo», МУ
1.2.2634-10 «Микробиологическая и молекулярно-генетическая оценка
воздействия наноматериалов на представителей микробиоценоза», МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов», МУ
1.2.2869-11 «Порядок оценки токсического действия наноматериалов на
лабораторных животных».
4.5. При выборе наноматериалов, являющихся объектами оценки
токсического действия на иммунную систему, необходимо принимать во внимание:
- возможность экспозиции работников нанотехнологических
производств, потребителей продукции наноиндустрии и населения в целом
наночастицами и наноматериалами на данной территории, в условиях промышленного
производства или при потреблении продукции определённого типа;
- данные литературы из источников, отвечающих критериям
научной полноты и достоверности о наличии у тестируемых наноматериалов и их
близких аналогов цитотоксических, генотоксических, мутагенных,
иммунотоксических свойств;
- степень потенциальной опасности наноматериалов для
здоровья человека в соответствии с МР
1.2.2522-09 «Выявление наноматериалов, представляющих потенциальную
опасность для здоровья человека».
4.6. Лаборатория (организация), проводящая исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должна быть
аккредитована на проведение работ в соответствующей области. В лаборатории должны
соблюдаться правила надлежащей лабораторной практики в соответствии с приказом
Министерства здравоохранения и социального развития Российской Федерации от 23
августа 2010 г. № 708н «Об утверждении Правил лабораторной практики».
4.7. В организации (лаборатории), проводящей исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должна быть
разработана программа по обеспечению качества проводимых исследований. Все
производственные операции проводятся в соответствии со Стандартными
операционными процедурами (СОП), осуществляемыми в целях обеспечения качества,
достоверности и воспроизводимости результатов исследования.
4.8. Организации (лаборатории), проводящие исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должны быть
укомплектованы необходимым оборудованием и средствами измерений, прошедшими
поверку (калибровку) в установленном порядке. Эксплуатация оборудования и
средств измерений проводится в соответствии с техническим паспортом и инструкцией
по применению. Результаты проведения поверки (калибровки) и текущего ремонта
оборудования фиксируются в специальном журнале, доступном в любое время
сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание.
Применяются средства измерений, имеющие сертификат и зарегистрированные в
Государственном реестре средств измерений.
4.9. Организации (лаборатории), проводящие исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должны иметь
помещения для содержания и работы с лабораторными животными (виварии, клиники
лабораторных животных), требования к которым изложены в МУ
1.2.2869-11 «Порядок оценки токсического действия наноматериалов на
лабораторных животных».
4.10. Организации (лаборатории), проводящие исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должны иметь условия
для работы с биологическим материалом, включая культуры иммунокомпетентных
клеток, чистые боксированные помещения, ламинарные шкафы с горизонтальным
потоком воздуха, обеспечивающие длительную экспозицию облучения внутренних
поверхностей ультрафиолетовым светом.
4.11. Организации (лаборатории), проводящие исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должны иметь
оборудование, обеспечивающее безопасность работы с наноматериалами
неорганического и биогенного происхождения: ламинарные вытяжные шкафы,
перчаточные боксы, снабжённые системой вентиляции (НЕРА-фильтры),
препятствующие поступлению аэрозоля наноматериалов в воздух производственных
помещений и в окружающую среду.
4.12. Документом, подтверждающим результаты проведённых
исследований по влиянию наноматериалов на функцию иммунитета, является отчёт о
проведённом исследовании. Отчет содержит следующие сведения:
- название исследования;
- адрес организации;
- даты начала и завершения исследований;
- цель и задачи исследования;
- характеристика тестируемых наночастиц и наноматериалов
(химический состав, CAS-номер, средний, минимальный и максимальный размер
частиц, форма частиц, наличие примесей, состав дисперсионной среды (носителя) в
соответствии с МУ
1.2.2636-10 «Проведение санитарно-эпидемиологической экспертизы продукции,
полученной с использованием нанотехнологий и наноматериалов»);
- применяемая биологическая модель и обоснование её
использования;
- перечень исследованных биологических образцов и
применяемых стандартных образцов;
- вид, линию, пол и возраст используемых лабораторных
животных;
- состав применяемых рационов, условия содержания животных;
- метод введения наночастиц/наноматериалов, применяемые
дозы, длительность и кратность введения;
- план (дизайн) исследования;
- перечень использованных средств измерений и
вспомогательного оборудования и режимы их работы;
- методы статистической обработки результатов;
- результаты исследования, представленные в виде обобщающих
таблиц, рисунков с соответствующей статистической обработкой и комментариев к
ним;
- заключение; выводы; список использованных источников.
Оформление отчёта о результатах исследования должно
соответствовать требованиям ГОСТ
7.32-2001 «Отчёт о научно-исследовательской работе. Структура и правила
оформления».
Отчет о результатах проведенного исследования составляется
ответственным исполнителем, утверждается руководителем организации и
скрепляется печатью организации.
4.13. Организация (лаборатория), проводящая исследования по
влиянию наночастиц и наноматериалов на функцию иммунитета, должна обеспечить
конфиденциальность результатов исследований в рамках принятых ею обязательств и
в соответствии с законодательством Российской Федерации.
5.1.1. Тестирование проводят на шести группах крыс-самцов
линии Вистар или линии Спрейг-Доули исходной массой 100 - 120 г (группы № 1 -
6). Численность групп животных составляет не менее 10 особей. Животные всех
групп на протяжении всего периода тестирования получают полусинтетический
рацион в соответствии с МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
Крыс размещают в клетках из ударопрочной пластмассы группами по 3 - 4 особи;
рацион и питьевую воду предоставляют в режиме свободного неограниченного
доступа.
Примечание: возможно использование при проведении тестирования
крыс других линий, а также нелинейных животных. Используемые схемы иммунизации
при этом должны быть модифицированы в соответствии с индивидуальными
особенностями иммунного реагирования у этих животных.
5.1.2. Тестируемые наночастицы и наноматериалы диспергируют в
дистиллированной воде и дополнительно обрабатывают ультразвуком (частота 44
кГц, время и мощность обработки устанавливаются опытным путём) во избежание
процессов агрегации. При необходимости степень диспергирования наноматериала
проверяют методом электронной микроскопии согласно МР
1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах
окружающей среды, живых организмах и пищевых продуктах». Дисперсию наночастиц
вводят ежедневно внутрижелудочно (в/ж) через зонд на протяжении 28 дней.
5.1.3. Иммунизацию крыс осуществляют к парентерально
вводимому модельному белковому антигену - овальбумину куриного яйца (ОБА). ОБА
представляет собой фосфопротеид, состоящий из одной аминокислотной цепи,
имеющий молекулярную массу 44 кД. Данный белок высоко иммуногенен для
большинства видов млекопитающих. В целях повышения интенсивности иммунного
ответа используют адъювант - свежеосаждённый гидроксид алюминия.
Иммунизацию осуществляют по следующей схеме. На 1-й, 3-й и
5-й день опыта крысам внутрибрюшинно (в/б) вводят дозу 100 мкг ОБА,
адсорбированного на 10 мг гидроксида алюминия в 0,2 см3 физиологического
раствора. На 21-й день опыта вводят дополнительно еще 10 мкг ОБА в тех же
условиях для индукции вторичного иммунного ответа.
5.1.4. Взятие биологического материала (цельная кровь,
сыворотка крови) осуществляют на 29-й день тестирования в три пробирки, из
которых одна обработана для предотвращения свёртываемости крови 1,6 мг
трикалиевой соли ЭДТА, а другая - 100 мм3 1-го раствора гепарина,
путём взятия крови из нижней полой вены под глубокой эфирной анестезией.
5.1.5. План (дизайн) тестирования
рекомендуется составлять в соответствии с данными, представленными в табл. 1.
Таблица 1
Типовой дизайн лабораторного теста по влиянию наночастиц
на показатели системы иммунитета у иммунизированных ОВА крыс
|
№№
п/п групп
|
Обозначение
групп
|
Число
крыс
|
Сенсибилизация
|
Внутрижелудочное
введение препаратов
|
|
1
|
Контроль
|
10
|
Не
сенсибилизированные
|
В/ж
введение дистиллированной воды в дозе 10 см3 на кг массы тела с 1
-го по 28-й дни опыта
|
|
2
|
Сенсибилизация
|
10
|
В/б
сенсибилизация овальбумином на Аl(ОН)3
на 1, 3, 5 и 21-й дни опыта
|
В/ж
введение дистиллированной воды 10 см3 на кг массы тела с 1-го по
28-й дни опыта
|
|
3
|
Введение
наночастиц, доза «А»
|
10
|
Не
сенсибилизированные
|
В/ж
введение дисперсии наночастиц в дистиллированной воде в дозе «А» с 1-го по
28-й дни опыта
|
|
4
|
Введение
наночастиц, доза «Б»
|
10
|
Не
сенсибилизированные
|
В/ж
введение дисперсии наночастиц в дистиллированной воде в дозе «Б» с 1-го по
28-й дни опыта
|
|
5
|
Сенсибилизация
+ наночастицы, доза «А»
|
10
|
В/б
сенсибилизация овальбумином на Аl(ОН)3 на 1, 3, 5 и 21-й дни опыта
|
В/ж
введение дисперсии наночастиц в дистиллированной воде в дозе «А» с 1 -го по
28-й дни опыта
|
|
6
|
Сенсибилизация
+ наночастицы, доза «Б»
|
10
|
В/б
сенсибилизация овальбумином на Аl(ОН)3
на 1, 3, 5 и 21-й дни опыта
|
В/ж
введение дисперсии наночастиц в дистиллированной воде в дозе «Б» с 1-го по
28-й дни опыта
|
Примечание: 1) величину дозы «А» наноматериала устанавливают на
основе анализа возможных сценариев пероральной экспозиции наноматериалом
человека в условиях контаминации пищевых продуктов и воды отходами деятельности
нанотехнологических производств и (или) возможного поступления наноматериала,
входящего в состав потребительской продукции с учётом возможной
неопределенности и 10-кратного коэффициента запаса, определяемого биологической
природой используемой модели (тестирование на грызунах); 2) доза «Б» является
10 - 100-кратно агравированной (увеличенной) в сравнении с дозой «А»; 3) при
выборе доз наноматериала следует учитывать данные о его собственных токсических
свойствах (LD50) - при наличии таковых.
5.1.6. Антиген для сенсибилизации готовят в соответствии со
следующей прописью.
Готовят следующие растворы:
1) 20 или 2 мг ОВА (5-кратно перекристаллизованный препарат
производства «Sigma-Aldrich» (США) или аналогичный) в 1 см3
стерильного апирогенного физиологического раствора (0,15 М NaCl) по ГФ СССР, X,
426;
2) 10 % по массе алюмокалиевые квасцы хч в дистиллированной
воде «для инъекций»;
3) 4 % по массе (1М) гидроксид натрия хч в дистиллированной
воде «для инъекций».
Все растворы фильтруют через мембранные фильтры с размером
пор 0,2 мкм для удаления пыли и бактерий.
В стерильном стеклянном флаконе смешивают 1 см3
раствора 1, 1 см3 раствора 2 и добавляли по каплям 0,6 см3
раствора 3. Смесь перемешивают и оставляют на 5 мин, после чего переносят в
центрифужную пробирку объёмом 10 см3. Отмывают образовавшийся осадок
троекратно объёмами по 10 см3 стерильного апирогенного
физиологического раствора; после каждой отмывки осадок седиментируют
центрифугированием при ускорении 3000 g в настольной лабораторной центрифуге с
охлаждением в течение 5 мин. Окончательно осадок диспергируют в 40 см3
стерильного апирогенного физиологического раствора. Полученную смесь вводят
крысам. Препарат антигена годен к использованию в течение не более 48 часов.
Примечание: перед использованием дисперсию антигена необходимо
взбалтывать.
Интенсивность гуморального иммунного ответа оценивают по
концентрации циркулирующих специфических IgG антител с помощью непрямого
твердофазного иммуноферментного теста на полистироле.
5.2.1.
Оборудование
|
Фотометр планшетный автоматический
«ЭФОС 9305» (производства «ОАО МЗ Сапфир», Россия) с интерференционными
светофильтрами на длину волны 492 и 620 нм или иной другой прибор с
аналогичными параметрами
|
|
|
Воздушный термостат на температуру
37 °С
|
|
|
Водяная баня на температуру 37 °С
|
|
|
Лабораторный настольный
встряхиватель
|
|
|
Устройство для отмывки лунок
иммуноферментных планшет на 8 каналов
|
|
|
Весы аналитические лабораторные электронные
с верхним пределом взвешивания 120 г 2-го класса точности ±0,1 мг с
метрологическими характеристиками по
|
ГОСТ
24104-2001
|
|
Весы технические лабораторные
электронные с верхним пределом взвешивания 120 г и ценой деления 0,01 г
|
ГОСТ
24104-2001
|
|
Иономер универсальный со
стеклянным электродом для измерения pH водных растворов; погрешность
измерения ±0,05 ед. pH
|
ГОСТ
27987-88
|
|
Секундомер
|
|
|
Пипетка полуавтоматическая
8-канальная регулируемая на объем 20 - 200 мм3 с наконечниками
|
|
|
Пипетки полуавтоматические
1-канальные на объемы 0 - 20; 20 - 200 и 200 - 1000 мм3 с
наконечниками
|
|
|
Дистиллятор лабораторный
|
|
|
Магнитная мешалка
|
|
|
Колбы мерные наливные на объемы
500, 1000 и 2000 см3
|
ГОСТ
1770-74
|
|
Цилиндры мерные на 25, 50, 100 см3
|
ГОСТ
1770-74
|
|
Стаканы стеклянные на 500 и 1000
см3
|
|
|
Шприц на объем 2 см3
|
ГОСТ
24861-91
|
5.2.2.
Материалы и реактивы
|
Овальбумин куриного яйца (ОБА), 5-кратно
перекристаллизованный или другой с аналогичными параметрами
|
|
|
Кроличьи моноспецифические
антитела против IgG крысы, меченные пероксидазой, лиофилизованные
производства НИИЭМ им Н.Ф. Гамалеи Минздравсоцразвития России или аналогичные
|
|
|
Нормальная лошадиная сыворотка
(НЛС)
|
|
|
Фосфат калия однозамещенный, хч
|
ГОСТ
4198-75
|
|
Фосфат калия двузамещенный
трехводный, хч
|
ГОСТ
2493-75
|
|
Хлорид натрия, хч
|
ГОСТ
4233-77
|
|
Лимонная кислота, хч
|
ГОСТ
908-2004
|
|
Фосфат натрия двузамещенный
12-водный, хч
|
ГОСТ
4172-76
|
|
Кислота серная d = 1,84, хч
|
ГОСТ
4204-77
|
|
Гидроксид натрия, хч
|
ГОСТ
4328-77
|
|
Натрий двууглекислый безводный, хч
|
ГОСТ
4201-79
|
|
Твин-20 (полиоксиэтиленсорбитан монолаурат)
производства «Sigma-Aldrich», Германия или другой с аналогичными параметрами
|
|
|
Орто-фенилендиамин градации
«Analytical grade»
|
|
|
Перекись водорода «медицинская» 33
%
|
ТУ 6-02-570-75
|
|
Желатин («пищевая марки П-11»)
|
ГОСТ 11293-89
|
|
Планшеты полистирольные разборные
плоскодонные со «средней» степенью связывания.
|
|
5.2.3.
Приготовление рабочих растворов
Буфер для иммобилизации антигенов. Навеску 4 г
гидроксида натрия хч переносят в мерную колбу на 100 см3, растворяют
и доводят дистиллированной водой до метки. Навеску 8,4 г натрия двууглекислого
помещают в стакан на 1000 см3, растворяют в 800 - 900 см3
дистиллированной воды на магнитной мешалке. Добавляют раствор гидроксида натрия
при перемешивании под контролем иономера до достижения pH 9,7 ± 0,1. Смесь
количественно переносят в мерную колбу на 1000 см3 и доводят водой
до метки.
Фосфатно-солевой буфер (ФСБ). Навеску 68 г калия
фосфата одно-замещенного переносят в мерную колбу на 500 см3,
растворяют и доводят дистиллированной водой до метки. Навеску 228 г калия
фосфата двузамещенного трехводного переносят в мерную колбу на 1000 см3,
растворяют и доводят дистиллированной водой до метки. Полученные растворы
смешивают под контролем иономера до достижения величины pH = 7,95 ± 0,05.
Навеску 180 г натрия хлорида переносят в мерную колбу на 1000 см3,
растворяют и доводят дистиллированной водой до метки. В мерную колбу на 2000 см3
вносят мерным цилиндром 20 см3 смеси раствора фосфатов и 100 см3
раствора натрия хлорида и доводят дистиллированной водой до метки.
Раствор Твин-ФСБ. В мерную колбу на 2000 см3
вносят с помощью шприца 2 см3 Твин-20 и доводят ФСБ до метки.
Раствор НЛС-ФСБ. Смешивают 100 см3 ФСБ с 1
см3 нормальной лошадиной сыворотки.
Блокирующий реагент. Смешивают 0,2 г желатины с 20 см3
ФСБ, оставляют на 16 ч в холодильнике, после чего нагревают при 37 °С на
водяной бане до полного растворения.
Субстратный буфер. В стакан на 1000 см3
вносят навески 26,3 г натрия фосфорнокислого двузамещенного 12-водного и 5,6 г
лимонной кислоты тригидрата. Растворяют на магнитной мешалке в 800 - 900 см3
дистиллированной воды, количественно переносят в мерную колбу на 1000 см3,
доводят до метки и проверяют pH, который должен составлять 6,0 ± 0,1.
Раствор субстрата (готовится непосредственно перед
употреблением). Навеску 6,0 ± 0,1 мг орто-фенилендиамина растворяют при
нагревании до 40 - 50 °С в 15 см3 субстратного буфера и
непосредственно перед нанесением на планшету вносят 40 мм3 33 %
перекиси водорода, разведенной 1:1 дистиллированной водой.
Останавливающий реагент (фиксатор). В мерную колбу на
1000 см3 вносят 900 - 950 см3 дистиллированной воды и
отмеряют цилиндром 28 см3 серной кислоты. Раствор перемешивают,
охлаждают до комнатной температуры и доводят дистиллированной водой до метки.
5.2.4. Проведение
анализа
В лунки полистирольных планшет вносят по 1,0 мкг ОВА в 100
мм3 0,1 М Na-бикарбонатного буфера pH 9,7 ± 0,1 и оставляют на 16 ч
в холодильнике. По окончании адсорбции антигена буфер удаляют путем промывки
0,01 М Na-фосфатным буфером pH 7,3 ± 0,1 с 0,15 М NaCl и 0,1 % Твин-20
(Твин-ФСБ). В лунки на 30 мин вносят по 200 мм3 1 % раствора
желатина в Твин-ФСБ. Отмывку повторяют, после чего вносят в лунки по 100 мм3
стандартных растворов крысиных антител к ОВА, очищенных методом аффинной
хроматографии, или исследуемых сывороток крови крыс в разведении 1:2000.
Разведения выполняют в ФСБ с 0,1 % бычьего сывороточного альбумина (БСА-ФСБ).
Планшеты инкубируют 120 мин при 20 °С со встряхиванием, после чего 5-кратно
отмывают Твин-ФСБ и вносят по 100 мм3 кроличьих антител к IgG крысы,
конъюгированных с пероксидазой, в разведении 1:4000 в БСА-ФСБ (примечание:
рабочее разведение конъюгированных антител может быть указано на ампуле с сухим
препаратом). Инкубацию и отмывку повторяют, после чего проводят реакцию со 100
мм3 субстрата 0,04 % о-фенилендиамина и 0,04 % Н2O2 в 0,1 М Na-цитрат-фосфатном буфере pH 6,00 ±
0,05 в течение 15 мин при 37 °С. Реакцию останавливают добавлением 100 мм3
1 н H2SO4. Оптическую плотность
измеряют при двух длинах волн: основной 492 нм и опорной (620 нм) на
автоматическом планшетном фотометре.
Концентрации IgG антител в сыворотках крыс определяют по стандартной
кривой путем линейной интерполяции в полулогарифмических координатах.
5.2.5.
Статистическая обработка результатов
Оценку воздействия наночастиц/наноматериалов на показатель
ответа антител проводят на основании результатов статистической обработки
результатов исследований в соответствии со следующими критериями:
а) однородность распределения показателя в шести группах
животных, параметрический тест на остаточную дисперсию ANOVA в целях контроля
специфичности применяемого теста определения антител;
б) факторный анализ с использованием параметрического теста
на остаточную дисперсию ANOVA по фактору воздействия наночастиц в группах 2, 5,
6 и парное сравнение животных 2-й группы с животными 5-й и 6-й групп с
использованием критериев непараметрической статистики (тесты Манна-Уитни,
Колмогорова-Смирнова) в целях выявления эффектов наноматериала, в том числе
дозозависимых.
При проведении статистической обработки рекомендуется
использовать профессиональные пакеты статистических программ.
Воздействие наночастиц/наноматериалов на показатели ответа
антител считается выявленным при достоверности различия на уровне значимости Р
= 0,05 и менее.
5.3.
Методы оценки клеточного звена иммунитета у
иммунизированных и не иммунизированных крыс
5.3.1. Метод оценки экспрессии клеточных маркеров
Экспрессию антигенов CD45RA, CD3, CD4, CD8, CD16a на
лимфоцитах периферической крови определяют методом прямого
иммунофлуоресцентного окрашивания клеток цельной крови с использованием панели
моноклональных антител, конъюгированных с флуоресцентными красителями: FITC,
РС7, АРС (10 Test, «Beckman Coulter», США, или другой с аналогичными
параметрами) и лизирующего/фиксирующего набора реагентов: VersaLyse Lysing
Solution («Beckman Coulter», США, PN IМ3648, или другой
с аналогичными параметрами), IOTest 3 Fixative Solution («Beckman Coulter»,
США, PN IM3515, или другой с аналогичными параметрами). В работе используют
следующие антитела: CD45RA (клон ОХ-33) - экспрессируется на В-лимфоцитах,
моноцитах, нативных Т-клетках; CD3 (клон IF4) - экспрессируется
на Т-лимфоцитах; CD4 (клон ОХ-38) - экспрессируется на Т-лимфоцитах-хелперах;
CD8 (клон ОХ-38) экспрессируется на цитотоксических Т-лимфоцитах; CD161a (клон
10/78) экспрессируется на NK-клетках.
Ход определения. В пробирку для проточного цитометра
(«Beckman Coulter», США, или другой с аналогичными параметрами) вносят 25 мм3
антител IOTest Anti-Rat CD3-FITC/CD4-PC7/CD8-APC PN А32909 («Beckman Coulter»,
США, или другой с аналогичными параметрами) и 25 мм3 цельной крови,
взятой от животных (крыс) в пробирки с с трикалиевой солью ЭДТА (1,6 мг К3ЭДТА
на 1 см3 крови). Перемешивают (1 с) на вортексе и инкубируют при
комнатной температуре (18 - 25° С) в течение 20 мин в темноте. После инкубации
добавляют 1 см3 лизирующего/фиксирующего раствора, приготовленного
путем смешивания 1 см3 VersaLyse с 25 мм3 IOTest 3
Fixative Solution, перемешивают на вортексе и инкубируют в течение 10 мин при
комнатной температуре.
Анализ окрашенных клеток осуществляют на проточном
цитофлуориметре («FC-500» производства «Beckman Coulter», США или другой с
аналогичными параметрами) по программе Cytomics СХР Software. Детекцию
флуоресценции выполняют при следующих длинах волн: λ1 = 525 нм, λ4 =
675 нм, λ5 = 755 нм. Популяцию лимфоцитов выделяют при помощи гейтирования
по параметрам малоуглового (FS) и бокового (SS) светорассеяния (рис. 1). Затем производят гейтирование популяции
лимфоцитов по каналу флуоресценции FL1 и SS Lin: гейт В - Т-лимфоциты (CD3+)
(рис. 2). Результаты регистрируют на двухпараметрической гистограмме
распределения CD3+ лимфоцитов (из гейта В) с использованием моноклональных
антител против CD4 и CD8, меченных РС7 и АРС, детектируемых на каналах
флуоресценции FL5 и FL4 (рис. 3).
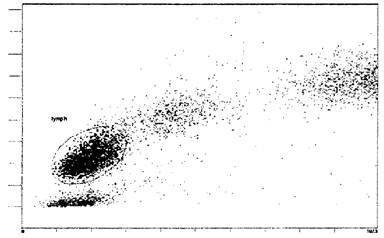
Рис. 1. Пример выделения гейта лимфоцитов на
гистограмме распределения
клеток периферической крови на двух каналах светорассеяния: FS Lin
(Size - размер клеток, отн. ед., ось ординат) и SS Lin (Granularity -
гранулярность, отн. ед., ось абсцисс). Эллипс на диаграмме - гейт лимфоцитов
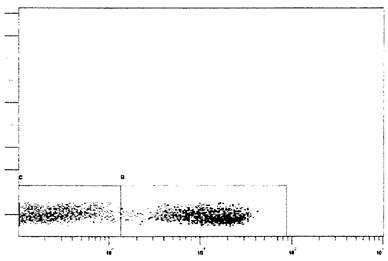
Рис. 2. Пример поэтапного гейтирования популяции
лимфоцитов по каналу
флуоресценции FL1 и SS Lin. Ось ординат - гранулярность, отн. ед., ось абсцисс
- интенсивность флуоресценции CD3-FITC, отн. ед. Прямоугольниками
выделены: гейт В - Т-лимфоциты (CD3+), гейт С - остальные клетки (CD3-)
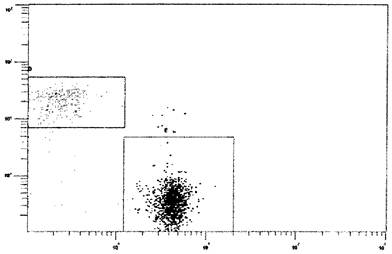
Рис. 3. Двухпараметрическая гистограмма распределения
CD3+ лимфоцитов
(из гейта В, см. рис. 2) с использованием
моноклональных антител против CD4 и
CD8, меченных РС7 и АРС. детектируемых на каналах флуоресценции FL5 и
FL4. Ось ординат - флуоресценция CD8-APC, отн. ед., ось абсцисс -
флуоресценция CD4-PC7, отн. ед. Прямоугольник D - CD3+CD8+ клетки,
прямоугольник Е - CD4+CD8+
Экспрессию CD45RA и CD161a на лимфоцитах периферической
крови определяют в отдельном тесте аналогичным способом с использованием набора
антител IOTest Anti-Rat CD3-FITC/CD45RA-PC7/CD161a-АРС PN А32910 («Beckman
Coulter», США или другой с аналогичными параметрами). Результаты исследования
регистрируют на двухпараметрической гистограмме распределения CD3- лимфоцитов
(из гейта С, см. рис. 2) с использованием
моноклональных антител против CD45RA и CD161а, меченных РС7 и АРС, детектируемых
на каналах флуоресценции FL5 и FL4 (рис. 4).
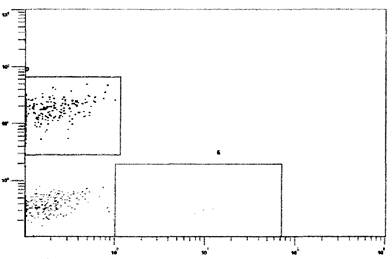
Рис. 4. Пример двухпараметрической гистограммы
распределения CD3-
лимфоцитов (из гейта С, см. рис. 2) с
использованием моноклональных антител
против и CD161a, меченных РС7 и АРС, детектируемых на каналах флуоресценции
FL5 и FL4. Ось ординат - флуоресценция CD161a-APC, отн. ед., ось абсцисс
- флуоресценция CD45RA-PC7, отн. ед. Прямоугольник D - CD161a+ клетки, Е -
CD45RA + клетки
5.3.2. Метод оценки фагоцитарной
активности нейтрофильных
лейкоцитов периферической крови крыс
Выделение лейкоцитов из цельной периферической крови
проводят по стандартной методике согласно МУ 1.2.2635-10 «Медико-биологическая
оценка безопасности наноматериалов» (пункт 4.7.1). Фагоцитарную активность
нейтрофильных лейкоцитов определяют с помощью набора реагентов Phagocytosis
Assay Kit (IgG FITC), производства «Cayman Chemical Company», США или другой с
аналогичными параметрами, согласно прилагаемой инструкции. Объектом фагоцитоза
служат частицы латекса, опсонизированные IgG FITC. Клеточную суспензию с
добавлением латекса инкубируют в течение 30 мин в двух пробирках: в термостате
при температуре 37 °С (положительная проба) и при температуре 4 °С (отрицательный
контроль). Анализ проб производят на проточном цитофлуориметре по программе
Cytomics СХР Software. Популяцию нейтрофильных лейкоцитов выделяют при помощи
гейтирования по параметрам малоуглового (FS) и бокового (SS) светорассеяния
(рис. 5). Результаты регистрируют на
канале флуоресценции Fl1 (процент клеток, поглотивших
частицы латекса) (рис. 6).

Рис. 5. Пример выделения гейта нейтрофильных лейкоцитов
(многоугольник А)
из фракции клеток, полученной методом градиентного центрифугирования
периферической крови и получения лейкоцитарной суспензии, на двух каналах
светорассеяния: FS Lin (ось ординат, отн. ед.) и SS Lin (ось абсцисс, отн. ед.)
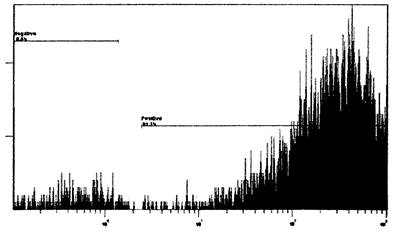
Рис. 6. Пример гистограммы распределения нейтрофилов
исследуемого образца
(интервал «Positive») и отрицательного контроля (интервал «Negative») по
интенсивности флуоресценции на канале FL1. Ось ординат - число клеток,
ось абсцисс - интенсивность флуоресценции, отн. ед.
Для оценки бактерицидного потенциала нейтрофильных
лейкоцитов и обусловленной этим эффективности киллинга фагоцитированных
микробных клеток используют набор FagoFlowEx Kit («ЕХВIO
Praha», Чешская Республика, или аналогичные), позволяющий идентифицировать
кислородный взрыв после стимуляции Е. coli (ED7035-1) в образцах
гепаринизированной цельной крови методом проточной цитофлуориметрии. После
поглощения бактерии в фагоците активируется НАДФН-оксидаза, которая опосредует
продукцию реакционноспособных форм кислорода (РСК). РСК внутри фагоцита
окисляют дигидрородамин 123 и превращают его в флуоресцентный родамин 123,
который детектируется на проточном цитофлуориметре. В качестве положительного
контроля используется образец, стимулированный ФМА
(форбол-12-миристат-13-ацетат), который инициирует кислородный взрыв без
адгезии и поглощения патогена. Популяцию нейтрофильных лейкоцитов выделяют при
помощи гейтирования по параметрам малоуглового (FS) и бокового (SS) светорассеяния
аналогично тому, как показано на рис. 5
(пример). Результаты регистрируют на канале флуоресценции Fl1
(рис. 7).
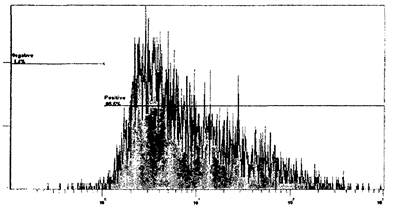
Рис. 7. Пример гистограммы распределения нейтрофилов,
стимулированных
Е. coli (интервал «Positive»), и нестимулированных образцов (интервал
«Negative») по интенсивности флуоресценции на канале FL1. Ось ординат -
число клеток; ось абсцисс - флуоресценция, отн. ед. Индекс стимуляции
рассчитывают как соотношение числа клеток в интервалах «Positive» и «Negative»
Вычисляют процентное соотношение позитивных и негативных
объектов и среднюю интенсивность флуоресценции. Результаты представляют как
индекс стимуляции (ИС) - отношение средней интенсивности флуоресценции
активированных нейтрофилов стимулированных образцов и отрицательных контролей.
5.3.3. Исследование апоптоза лимфоцитов периферической крови
крыс
Принцип метода изучения степени апоптоза лимфоцитов основан
на свойстве аннексина V связываться с фосфатидилсерином клеточной мембраны и
способности 7-AAD (7-амино-актиномицин) встраиваться между цитозином и гуанином
двухцепочечной ДНК клеток с нарушенной целостностью мембраны. На ранних стадиях
апоптоза целостность клеточной мембраны сохраняется, но происходит конверсия
мембранных фосфолипидов и появление фосфатидилсерина на поверхности клетки.
Аннексии V с высокой аффинностью связывается с фосфатидилсерином и
идентифицирует «ранний» апоптоз. Поздняя фаза апоптоза сопровождается не только
утратой асимметрии фосфолипидов мембраны, но и нарушением целостности мембраны,
фрагментацией ДНК и резким возрастанием мембранной проницаемости для катионных
красителей. Комбинированная окраска аннексии V-FITC и 7-AAD позволяет
идентифицировать неапоптозные - живые клетки (при сочетании аннексии V-негативные/7-ААD-негативные),
ранние проапоптотические изменения (при сочетании аннексии V-позитивные/7-ААD-негативные), поздние варианты клеточной гибели (при
сочетании аннексии V-позитивные/7-ААD-позитивные
клетки) и мертвые клетки (аннексии V-негативные/7-ААD-позитивные
клетки).
Выделение лимфоцитов из цельной периферической крови
проводят по стандартной методике (МУ 1.2.2635-10 «Медико-биологическая оценка
безопасности наноматериалов», пункт 4.7.1). Клеточную суспензию дважды отмывают
холодным, забуференным 0,01 М фосфатами 0,15М раствором хлорида натрия, pH 7,2
- 7,4 путем центрифугирования при 300 g 5 мин и готовят пробу с концентрацией
клеток 1×106 см-3 в аннексиновом буфере (Annexin V
Binding Buffer, кат. № 731728, производства «Beckman Coulter», США, или другой
с аналогичными параметрами). Окрашивание лимфоцитов производят конъюгированным
с флуорохромом (FITC) аннексином V (AnV-FITC) и
витальным красителем 7-AAD (Annexin V-FITC/7-AAD Kit, кат. № IM3614,
производства «IМ-MUNOTECH», Франция, или аналогичные).
В пробирку для проточного цитометра вносят: 100 мм3 пробы, 10 мм3
аннексина V и 20 мм3 7-AAD, перемешивают на вортексе 1 с и
инкубируют 15 мин в темноте на льду. После инкубации в пробирку добавляют 400
мм3 аннексинового буфера. Анализ окрашенных клеток осуществляют на
проточном цитофлуориметре по программе Cytomics СХР Software. Детекцию
флуоресценции выполняют при следующих длинах волн: λ1 = 525 нм, λ4 =
675 нм. Популяцию лимфоцитов выделяют при помощи гейтирования по параметрам
малоуглового (FS) и бокового (SS) светорассеяния (рис. 8). Результаты представляют в виде процентного
соотношения живых клеток и лимфоцитов, находящихся на разных стадиях апоптоза,
на 10000 просчитанных объектов в каждом образце (рис. 9).
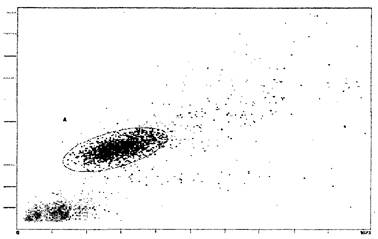
Рис. 8. Пример выделение гейта лимфоцитов (эллипс) на
двух каналах
светорассеяния: FS Lin и SS Lin. Ось ординат - размер клеток, отн. ед.,
ось абсцисс - гранулярность, отн. ед.
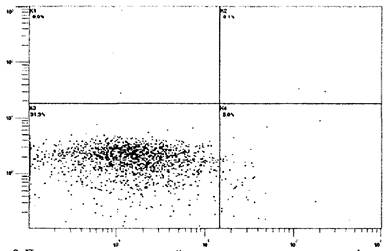
Рис. 9. Пример двухпараметрической гистограммы
распределения лимфоцитов
по степени апоптоза: квадрант К3 - живые клетки (аннексии V-/7-AAD-),
квадрант К4 - ранние проапоптотические изменения (аннексии V+/7-AAD-),
квадрант К2 - поздняя стадия апоптоза (аннексии V+/7-AAD+) и квадрант
К1 - мертвые клетки (аннексии V-/7-AAD+). Детектируется на каналах
флуоресценции FL1 (ось абсцисс) и FL4 (ось ординат)
5.3.4. Оценка гематологических показателей
Гематологические показатели, определяемые в цельной крови
иммунизированных и не иммунизированных животных, включают: определение общего
гемоглобина, показателя гематокрита, содержания эритроцитов, среднего
содержания гемоглобина в эритроците, среднего объёма эритроцита, средней
концентрации гемоглобина в эритроците, содержания лейкоцитов, нейтрофилов,
эозинофилов, базофилов, лимфоцитов, моноцитов, содержания тромбоцитов, среднего
объёма тромбоцита, относительного объёма тромбоцита в цельной крови.
При определении гематологических показателей используют
стандартные методики, применяемые при клиническом анализе крови*. При анализе
возможно использование автоматических гематологических анализаторов, например
«Coulter АС ТТМ 5 diff OV», производства «Beckman Coulter», США, или другой с
аналогичными параметрами. В этом случае подготовку и обработку биологического
материала для анализа проводят в соответствии с инструкцией к применяемому
оборудованию.
________
«Лабораторные
методы исследования в клинике»: Справочник/Под редакцией Меньшикова В.В. М.:
Медицина, 1987.
5.3.5. Методы определения продукции цитокинов у крыс
При определении цитокин-продуцирующей способности
иммунокомпетентных клеток у иммунизированных и не иммунизированных крыс
рекомендуется использовать метод оценки экспрессии генов цитокинов с помощью
полимеразной цепной реакции с обратной транскрипцией согласно МР
1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в
модельных системах in vivo», пп. 7.1 - 7.3; 7.8 - 7.11. Субстратом для
анализа являются клетки селезенки (спленоциты) или лейкоциты периферической
крови, выделенные по стандартным методикам (МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов»; МР
1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в
модельных системах in vivo»).
В качестве более простой и дешевой альтернативы данного
метода рекомендуется использовать иммуноферментное определение уровней
цитокинов в сыворотке крови. У сенсибилизированных и несенсибилизированных
животных при этом рекомендуется проводить определение цитокинов TNFα,
IL-2, IL-4, IL-5, IL-6, IL-8, IL-10 и некоторых других в зависимости от задач
исследования и ожидаемого характера действия тестируемого наноматериала. В
качестве примера ниже приведена методика иммуноферментного определения крысиных
IL-6, IL-10 и TNFα.
Определение IL-6, IL-10 и TNFα в сыворотке крови крыс
проводят методом иммуноферментного анализа (ИФА) с использованием коммерческих
наборов («Bioscience», производства «Bender MedSystems GmbH», Австрия, или
другой с аналогичными параметрами). Принцип метода (двухвалентный твердофазный
биотин-стрептавидиновый иммуноферментый тест) заключался в последовательном
нанесении на планшет с иммобилизованными моноклональными антителами к
определяемому цитокину 1) образцов и стандартов (IL-6, IL-10, TNFα) и 2)
конъюгата антител против крысиных (IL-6, IL-10 или TNFα) с биотином. После
2-часовой инкубации и отмывки буфером, содержащим ФСБ с 1 % Твин 20,
сформировавшиеся на поверхности полистирола тройные иммунные комплексы
антитело(1)-цитокин-антитело(2)-биотин выявляют внесением конъюгата
стрептавидина с пероксидазой хрена (Streptavidin-HRP) на 1 час. Все
перечисленные инкубации проводят при комнатной температуре (18 - 25 °С). Затем
повторяют процедуру отмывки с использованием буфера, содержащего ФСБ с 1 % Твин
20, и вносят раствор субстрата (0,04 %-я перекись водорода +0,04 %
тетраметилбензидин). Цветную реакцию останавливают с использованием 1М
фосфорной кислоты, оптическую плотность измеряли при двух длинах волн: основной
(450 нм) и опорной (620 нм) на автоматическом планшетном фотометре.
Концентрацию цитокинов в сыворотке крови определяют по стандартной кривой с
использованием метода линейной интерполяции (возможно использование
программного обеспечения фотометра в режиме «кусочной аппроксимации»),
5.4.1. Принцип метода
Метод оценки гуморального звена иммунитета у мышей,
иммунизированных корпускулярным антигеном, основан на образовании вокруг
клеток, продуцирующих антитела с высокой гемолитической активностью
(IgM-антитела), сферической зоны лизиса после добавления антигена и
комплемента. Оценка показателей клеточного иммунитета при этом производится
аналогично тестам на крысах (раздел 5.3).
5.4.2.
Экспериментальная модель
Мышам вводят внутрибрюшинно (в/б) или внутривенно (в/в)
суспензию трижды отмытых в стерильном апирогенном физиологическом растворе
эритроциты барана (ЭБ) в субоптимальной дозе, равной 5×107 ЭБ/мышь.
Введение наноматериалов животным проводится однократно или многократно в двух
разных дозах (принцип установления которых приведён в п. 5.1.5 настоящих методических рекомендаций) при
различных путях воздействия (согласно МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности
наноматериалов»), при этом пути введения антигена и наноматериалов должны
отличаться. На 5-е сутки после иммунизации при внутрибрюшинном введении (или на
4-е сутки после внутривенной иммунизации) определяют число антителобразующих
клеток АОК в селезёнке. Дизайн эксперимента включает 6 групп животных численностью
не менее 6 (предпочтительно 10) особей: 3 группы с введением ЭБ на фоне
нулевой, низкой и высокой дозы наноматериала и три аналогичные группы без
введения ЭБ, что позволяет выявить возможное спонтанное бляшкообразование у
неиммунизированных животных, обусловленное неспецифическим эффектом
наноматериала. Обнаружение поликлональной активации лимфоцитов у
неиммунизированных животных будет свидетельствовать о риске развития
аутоиммунного состояния под действием наноматериала.
5.4.3.
Материалы и методы
Оборудование и материалы:
|
Водяная баня (термостат) на
температуру 37 - 50 °С
|
|
|
Центрифуга лабораторная настольная
с охлаждением
|
|
|
Чашки Петри стеклянные или
пластиковые одноразового применения
|
|
|
Пробирки стеклянные со шлифом № 14
и пробкой
|
ГОСТ
25336-82
|
|
Водяная баня (термостат) на
температуру 37 - 50 °С
|
|
Реактивы:
|
Агароза (производства «Sigma»,
США, или другая с аналогичными параметрами)
|
|
|
Раствор Хэнкса без фенолового
красного (производства «Sigma», США, или другой с аналогичными параметрами)
|
|
|
Стерильный физиологический раствор
для инъекций по ГФ СССР, X, 426
|
|
|
Эритроциты барана (ЭБ) (получают
из свежесобранной периферической венозной крови путём удаления фибрина
осторожным встряхиванием при комнатной температуре 10 - 15 мин со стеклянными
шариками (бусами) диаметром 3 - 5 мм с последующей трёхкратной отмывкой физиологическим
раствором в настольной центрифуге с охлаждением (5 мин, 1500 об./мин);
применение антикоагулянтов при взятии образца крови не рекомендуется)
|
|
|
Комплемент морской свинки (сухой лиофилизованный
препарат, производства «Sigma», США, или другой с аналогичными параметрами; в
качестве заменителя возможно использование цельной сыворотки крови интактных
морских свинок)
|
|
Приготовление агарозной смеси.
Расплавленную в дистиллированной воде 2 %-ю агарозу
добавляют к равному объему нагретого до 45 - 48 °С однократного и двукратного
(10-кратный концентрат, разведённый в 5 раз дистиллированной водой) раствора
Хэнкса в соотношениях - 1:1:1.
Проведение анализа
В агарозную смесь вносят суспензию ЭБ (концентрация (6 -
8)×109 см3) из расчёта 70 - 80 млн клеток на 1 см3
агарозной смеси. По 2,75 см3 полученной смеси разливают по
пробиркам, предварительно помещённым в водяную баню с температурой 46 - 48 °С.
Далее в пробирки, содержащие агарозу с ЭБ, вносят 0,05 - 0,2 см3
суспензии спленоцитов (получают, как указано в МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов», п. 4.7.1)
(концентрацию клеток определяют в предварительных опытах). Содержимое пробирок
встряхивают и выливают на чашки Петри диаметром 100 мм. Осторожным покачиванием
и вращением смесь равномерно распределяют по дну чашки. После застывания
агарозы чашки помещают в термостат при 37 °С на 1 час, после чего на
поверхность агарозы выливают по 3 см3 раствора сухого комплемента
морской свинки (разведение в физиологическом растворе 1:5) и вновь инкубируют в
термостате при 37 °С в течение 45 мин. После инкубации комплемент сливают и
проводят подсчёт образовавшихся бляшек (зон гемолиза). При относительно
небольшом числе бляшек (примерно до 120 на чашку) их подсчитывают полностью.
Если же бляшек было больше, то их подсчёт производят следующим образом. В листе
плотной чёрной бумаги вырезают отверстие в форме квадрата со стороной 1 см
(т.е. площадью 1 см2). Подкладывая лист с вырезанным квадратом под
донышко чашки, просчитывают выборочное число бляшек в 10 таких квадратах в
разных участках чашки с последующим перерасчётом на всю поверхность агарозы в
чашке (коэффициент перерасчёта для чашек диаметром 100 мм равен 6,88). Зная
объём клеточной суспензии, наносимый на чашку, и общий объём селезёночной
суспензии, вычисляют количество бляшек (АОК) на всю селезёнку.
Оценка результатов. При статистической обработке
полученных данных определяли среднюю геометрическую числа АОК и стандартную
ошибку. Сравнивают число АОК у животных соответствующих групп, получавших и не
получавших наноматериалы. При сравнении результатов применяют непараметрические
критерии Манна-Уитни или Колмогорова-Смирнова. Достоверное различие (Р <
0,05) свидетельствует о влиянии наноматериала на функциональную активность
В-лимфоцитов.
Тестирование воздействия наноматериалов на иммунную функцию
у несенсибилизированных лабораторных животных (линейных и нелинейных мышей)
проводится в две стадии. На первой стадии животным, получающим стандартный
сбалансированный рацион, вводятся наноматериалы при различном пути их
поступления (внутрижелудочно, ингаляционно, парентерально) однократно или в
условиях подострого токсикологического тестирования (длительностью до 60 суток)
в соответствии с МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
По окончании введения у животных производится отбор биологических проб органов
и тканей иммунной системы (кровь, альвеолярные или перитонеальные лейкоциты,
селезенка).
На второй стадии полученные от животных иммунокомпетентные
клетки подвергаются в строго контролируемых условиях in vitro
функциональному тестированию. При этом используется набор методик, ранее
утверждённых для оценки безопасности наноматериалов в клеточных культурах (МУ
1.2.2635-10 «Медико-биологическая оценка безопасности наноматериалов», пп. 4.9
- 4.11). В ряде случаев при проведении функциональных тестов дополнительно
рекомендуется подвергать клетки воздействию тех же наноматериалов, что и
применявшиеся при введении животным, что является показателем «сенсибилизации»
организма наноматериалом. В качестве контрольных образцов при этом выступают
образцы иммунокомпетентных клеток от интактных животных, получавших только
носители наноматериалов («плацебо»).
В целом такой методический подход может быть охарактеризован
термином «тестирование ex vivo».
6.1.
Экспериментальная модель
Для оценки безопасности наноматериалов на иммунную систему
используют линейных мышей (линии BALB/c, СВА, С57В1/6) и/или нелинейных мышей
самок, с исходной массой тела (18 ± 2) г, возрастом 6 - 8 недель.
На протяжении всего периода содержания в виварии, включая
период тестирования наноматериалов, животные получают готовый сбалансированный
сухой гранулированный корм производства сертифицированных производителей
(например, ООО «Лабораторкорм», г. Москва, Россия или аналогичный) и питьевую
воду в режиме свободного неограниченного доступа.
Формируют группы животных численностью не менее 5 (предпочтительно
10) особей. Опытным группам животных вводят исследуемые наночастицы или
наноматериалы одним из возможных способов, соответствующих путям поступления
наноматериала в организм в условиях его реального использования (ингаляционным,
внутрижелудочным, парентеральным или другим), однократно или в течение
длительного периода времени, не менее, чем в двух дозах, различающихся не
менее, чем в 10 раз (при выборе дозы обработки следует учитывать возможные
сценарии экспонирования наноматериалом в условиях его применения, а также
сведения об острой токсичности наноматериала (LD50), если таковые
имеются). Помимо этого выделяют одну группу интактных животных (контроль) и, в
случае необходимости, одну группу, получавшую плацебо (носитель тестируемого
наноматериала). Выделение последней группы обязательно при использовании
носителя, имеющего собственную токсикологическую характеристику. При
формировании групп животных и составлении плана (дизайна) тестирования
используют принципы, изложенные в МУ
1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов»
(пункт 6.4.7) и МУ
1.2.2869-11 «Порядок оценки токсического действия наноматериалов на
лабораторных животных» (пункты 4.3 - 4.6).
Для изучения подострой иммунотоксичности животных вводят
наноматериалы ежедневно на протяжении 21 дня. Исследования проводят на 1-е,
30-е и 60-е сутки после окончания введения наноматериалов.
Для выражения дозы наноматериала используют единицы массы
наноматериала (мг). Дополнительно характеризовали такие параметры размерности,
как отношение количества частиц к массе наноматериала (1012 мг-1)
и отношение площади поверхности частиц к массе наноматериала (см2/мг).
Ингаляционное экспонирование животных проводят
аэрозолем наноматериала в затравочной камере. Продолжительность сеанса
обработки составляет не менее 15 мин. Затравочная камера имеет объем не менее
150 дм3 и должна позволять одновременную обработку до 60 мышей,
помещаемых в специальные корзинки. Аэрозоль генерируют из водной дисперсии
наноматериалов калиброванным стеклянным распылителем, представляющим
конструктивно трубку Вентури с объемом распыляемой жидкости до 7 см3.
Система снабжается НЕРА-фильтрами на входе воздушного потока для удаления
возможных наноразмерных примесей к атмосферному воздуху, способных повлиять на
результаты тестирования. На выходе воздух пропускают через НЕРА-фильтр с
последующей термообработкой при температуре 840 °С. Камера должна иметь
возможность регулирования времени ингаляции аэрозоля, времени распада облака.
Возможно применение камеры, управляемой с помощью ПЭВМ, использующей
специализированное программное обеспечение.
Внутрижелудочное введение наноматериалов животным
осуществляют через зонд натощак ежедневно в дозе 0,2 см3 водной дисперсии
наночастиц соответствующей концентрации (от 0,01 до 1,0 % по массе),
обработанной ультразвуком (частота 44 кГц, мощность и время обработки
устанавливаются эмпирически).
Парентеральное введение наноматериалов животным
осуществляют подкожно, внутривенно или внутрибрюшинно с использованием шприца
ежедневно в дозе 0,2 см3 на мышь.
Получение биологического материала для исследования.
Отбирают кровь с гепарином и без него (для получения
форменных элементов и сыворотки, соответственно), перитонельные макрофаги или
нейтрофилы (у животных, получавших наноматериалы ингаляционно - альвеолярные
макрофаги) и селезенку. Отбор проб биологического материала проводят в
соответствии с МУ 1.2.2745-10 «Порядок отбора проб для характеристики действия
наноматериалов на лабораторных животных» или в соответствии с методиками,
приведёнными ниже.
Для получения первичных культур иммунокомпетентных клеток
используют стандартные методики, рекомендованные для конкретного вида клеток
(МУ 1.2.2635-10 «Медико-биологическая оценка безопасности наноматериалов», п.
4.7.1). Для унификации условий обработки первичные культуры иммунокомпетентных
клеток на протяжении всех экспериментов культивируют в стандартных условиях:
при 37 °С, 5 % СO2 и 95 % влажности, в
стандартных питательных средах, которые рекомендованы для конкретного вида
клеток (МУ 1.2.2635-10 «Медико-биологическая оценка безопасности
наноматериалов», п. 4.6). После приготовления в соответствии с рецептурой,
среды и растворы стерилизуют пропусканием через фильтры с диаметром пор 0,22
мкм.
Непосредственно перед тестированием иммунокомпетентные
клетки стандартизируют по концентрации (рекомендованной для конкретного метода
и вида клеток) с помощью подсчета клеток в присутствии раствора трипанового
синего в камере Горяева или с использованием автоматического счетчика
(например, Counter «Countess™», производства «Invitrogen» или другой с
аналогичными параметрами). Разброс по концентрации клеток в сравниваемых
группах животных не должен превышать ±10 %.
Методика отбора образца перитонеальных нейтрофилов мыши
Для рекрутизации нейтрофилов в брюшную полость мышам вводят
2 см3 мясо-пептонного бульона и через 2 ч подвергают эвтаназии путем
ингаляции углекислым газом. Мышей фиксируют брюшком вверх на препаровальном
столике, обрабатывают место намечаемого разреза 70 %-м этиловым спиртом и,
разрезав кожные покровы, отворачивают их «конвертом», обнажая стенку брюшной
полости. Делают небольшое отверстие в брюшной стенке, чтобы свободно проходил
носик пипетки, и пятикратно промывают брюшную полость 2 - 4 см3
холодного (4 °С) ФСБ. Полученную из брюшной полости клеточную суспензию
помещают на ледяную баню и используют для экспериментов не позже, чем через 1 ч
после получения.
Методика выделения бронхолегочного лаважа и альвелярных
макрофагов
В группах мышей, получавших наноматериалы ингаляционно,
вместо перитонеальных макрофагов и нейтрофилов выделяют альвеолярные макрофаги
из бронхолегочного лаважа
Мышей подвергают эвтаназии ингаляцией углекислого газа.
После этого из грудной полости целиком отпрепаровывают бронхолёгочный комплекс
и отмывают его от крови в стерильном ФСБ, pH 7,2. Посредством затупленной иглы
через трахею вводят среду 199 с гепарином (5 ед. на см3 среды) в
количестве 3 см3. Содержимое отсасывают шприцом, сливают через
капроновый фильтр в пробирки, помещают на ледяную баню и используют для
тестирования не позже, чем через 1 ч после получения. Клеточную суспензию
отмывают в ФСБ 10 мин с центрифугированием при 400 g в центрифуге с
охлаждением. Для выявления воспалительных реакций используют супернатант, в
котором анализируют цитокины и определяют содержание белка по Брэдфорду. Для
анализа фагоцитарной функции макрофагов используют клеточную суспензию.
Основное оборудование:
|
Проточный цитофлуориметр (FC-500,
производства «Beckman Coulter», США или другой с аналогичными параметрами)
|
|
|
Сканер флюоресцентных,
хемилюминесцентных, фотометрических сигналов, плашечный термостатируемый универсальный,
Victor 3Х, производства «Perkin Elmer», США или другой с аналогичными
параметрами
|
|
|
Встряхиватель вибрационный типа
«Вортекс» со скоростью вращения до 3000 об./мин
|
|
|
Шейкер планшетный термостатируемый
|
|
|
Ламинарный шкаф марки ЛШ1,
производства «Biokom» или другой с аналогичными параметрами
|
|
|
Центрифуга с охлаждением со
скоростью вращения ротора до 3000 об./мин для пробирок вместимостью до 15 см3
|
|
|
СO2-инкубатор
|
|
|
Инвертированный микроскоп Биолам
П2-1,
|
|
|
ЛОМО, С-Петербург, Россия или
другой саналогичными параметрами
|
|
|
Автоматический счетчик клеток
(Counter «Countess™», производства «Invitrogen», США или другой с
аналогичными параметрами)
|
|
|
Камера Горяева
|
|
|
Холодильник бытовой электрический
|
ГОСТ
26678-85
|
|
Морозильная камера бытовая,
обеспечивающая температуру -18 °С
|
|
|
Мембранные установки для получения
деионизованной воды
|
ОСТ 11-029.003-80
|
|
Облучатель бактерицидный настенный
|
|
|
Автоклав (ВК-75, завод
медоборудования, Тюмень, Россия или другой с аналогичными параметрами)
|
|
|
Баня водяная с электрическим подогревом
|
|
Вспомогательные материалы
|
Пробирки пластиковые стерильные с
крышкой вместимостью 15 см3, производства «Costar», США или другие
с аналогичными параметрами
|
|
|
Пробирки TRUCount BD или
аналогичные
|
|
|
Пробирки для цитометрического
анализа FALCON, BD или аналогичные
|
|
|
Микроцентрифужные пробирки (1,5 см3)
(«Eppendorf», Германия или другие с аналогичными параметрами)
|
|
|
Пипетки полуавтоматические
1-канальные на объемы (0,5 - 10, 10 - 100, 100 - 1000, 500 - 5000 мм3)
|
|
|
Наконечники пластиковые объемом 1
- 200, 200 - 1000 и 500 - 5000 мм3
|
|
|
Стерильные пластиковые пипетки
градуированные, производства «Corning Costar», США или другие с аналогичными параметрами
|
|
|
Пластиковые флаконы для культур
клеток 25 см3, производства «Coming Costar», США или другие с
аналогичными параметрами
|
|
|
Пластиковые планшеты для культур
клеток 96-луночные, производства «Coming Costar», США или другие с аналогичными
параметрами
|
|
|
Колбы плоскодонные конические
разной вместимости
|
ГОСТ
1770-74
|
|
Колбы мерные (50, 100, 200, 500,
1000 см3)
|
ГОСТ
1770-74
|
|
Цилиндры стеклянные мерные
лабораторные вместимостью 25, 100, 1000 см3
|
ГОСТ
1770-74
|
|
Лабораторный штатив
|
ТУ 64-1-2669-73
|
|
Перчатки резиновые
|
ГОСТ
3-88
|
|
Камера Горяева для счета форменных
элементов крови, модель 851
|
|
Реактивы:
|
Среда Игла в модификации Дульбекко
(DMEM) сухая
|
|
|
Среда РПМИ-1640 сухая
|
|
|
Раствор Хэнкса без фенолового
красного
|
|
|
Фосфатно-солевой буфер (ФСБ)
|
|
|
Фиколл-верографин плотностью 1,077
|
|
|
Фетальная сыворотка теленка
|
|
|
L-глутамин
|
|
|
Трипсин
|
|
|
Раствор Версена
|
|
|
Гентамицина сульфат, 4 %-й раствор
для инъекций в ампулах
|
|
|
Тест-система для определения
лактатдегидрогеназы CytoTox 96, производства «Промега», США или другая с
аналогичными параметрами
|
|
|
Тест-система для определения
мышиного фактора некроза опухоли-альфа (TNF-α) методом иммуноферментного
анализа (ИФА), производства «Amersham Biosciences», США или другая с
аналогичными параметрами
|
|
|
Тест-система для определения
мышиного интерферона - гамма (IFN-γ) методом ИФА, производства «Amersham
Biosciences», США или другая с аналогичными параметрами Люминол
(5-amino-2,3-dihidro-1,4-phthalasinedione)
|
|
|
Гепарин
|
|
|
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий
бромид (МТТ)
|
|
|
Нитросиний тетразолий (НСТ)
|
|
|
Конконавалин А (КонА)
|
|
|
Липополисахарид (ЛПС) Escherichia
coli
|
|
|
Моноклональные антитела к CD3 мыши
РerСР, CD19 РЕ, CD4 АРС, CD8 FITC (BD Farmigem или
аналогичные)
|
|
|
Изотипические контроля IgG1-FITC, IgG1-PerCP,
IgG2-PE, IgG1-APC (BD Farmigem или аналогичные)
|
|
|
FACS Lysing
Solution, BD
|
|
|
Азид натрия
|
|
|
Параформальдегид
2 %
|
|
|
Тритон Х-100 РНК-аза
|
|
|
7-AAD (7-амино-актиномицин D)
|
|
|
Бромистый этидиум
|
|
|
Форболмиристилацетат (ФМА)
|
|
|
Зимозан
|
|
|
Бычий сывороточный альбумин (БСА)
|
|
|
Диметилсульфоксид
|
|
|
Натрия додецилсульфат
|
|
|
Краситель трипановый синий
|
|
|
Лимонная кислота, чда
|
ГОСТ 2158-76
|
|
Натрия цитрат, чда
|
ГОСТ
22280-76
|
|
Аммоний хлористый, чда
|
ГОСТ
3773-72
|
|
Натрия фосфат однозамещенный, чда
|
ГОСТ
245-75
|
|
Натрия фосфат двузамещенный, чда
|
ГОСТ
4172-76
|
|
Натрий хлористый, хч
|
ГОСТ
4233-77
|
|
Калий фосфорно-кислый
однозамещенный, чда
|
ГОСТ
4198-75
|
|
Едкий натр, хч
|
ГОСТ 2263-79
|
|
Соляная кислота, хч 1Н
|
ГОСТ
3118-77
|
|
Серная кислота, хч 1Н
|
ГОСТ 4278-76
|
|
Вода дистиллированная
|
ГОСТ 6709-72
|
|
Перекись водорода 33 %-я
медицинская
|
|
|
Спирт этиловый технический
|
ГОСТ
17299-78
|
Приготовление растворов и питательных сред
Методики получения растворов и питательных сред представлены
в МУ 1.2.2635-10 «Медико-биологическая оценка безопасности наноматериалов», п.
4.6.
6.3.1. Метод оценки жизнеспособности иммунокомпетентных
клеток
в тесте с трипановым синим
Принцип метода. Краситель трипановый синий не
способен проникать через цитоплазму жизнеспособных клеток.
Ход исследования. Смешивают равные количества
суспензии иммунокомпетентных клеток и 0,16 - 0,20 %-го раствора трипанового
синего, приготовленного на сбалансированном растворе Хэнкса или на
физиологическом растворе. Клетки инкубируют 10 мин при 37 °С и подсчитывают в
камере Горяева процент окрашенных клеток (мертвых) от общего количества
клеточных элементов.
6.3.2.
Метод оценки жизнеспособности
иммунокомпетентных клеток в МТТ-тесте
Исследование проводят, как указано в МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов», п. 4.9.1, но без
добавления наноматериалов к тестируемым клеткам.
6.3.3.
Метод оценки жизнеспособности иммунокомпетентных клеток
с использованием красителя 7-амино-актиномицин D (7-AAD)
Принцип метода. Биологические свойства красителя
7-AAD изложены в п. 5.3.3
настоящих методических рекомендаций.
Ход исследования. Клетки в концентрации 1×106
см3 переносят по 100 мм3 в маркированные пробирки для
проведения цитофлюориметрического анализа (Falcon, BD). Добавляют 7-AAD и CD45
FITC из расчета по 5 мм3 красителя на 1×106 клеток.
Инкубируют 30 мин при 40 °С в темноте.
Если используется гепаринизированная кровь, эритроциты
предварительно лизируют. Для этого в каждую пробирку вносят по 1 см3
1 X Facs Lysing Solytion (BD), аккуратно перемешивают на вортексе в течение 10
с, инкубируют 10 - 12 мин в темноте при комнатной температуре (18 - 20 °С).
Лейкоциты осаждают центрифугированием при 300 g в течение 5 мин. Надосадочную
жидкость удаляют и дважды отмывают лейкоциты в ФСБ (300 мм3), 400 g,
5 мин.
Анализ проводят на проточном цитофлюориметре в программе
Cell Quest Pro, как описано в п. 5.3.3.
Процентное количество флюоресцирующих клеток по F13 каналу соответствует
процентному содержанию поврежденных клеток.
6.3.4. Метод оценки
жизнеспособности иммунокомпетентных клеток
по уровню активности лактатдегидрогеназы
Исследование проводят, как указано в МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов», п. 4.9.2, но без
добавления наноматериалов к тестируемым клеткам.
6.3.5. Метод оценки
влияния наноматериалов на количественное
соотношение субпопуляций иммунокомпетентных клеток
Применяют метод проточной цитофлуориметрии, аналогичный
подробно изложенному в п. 5.3.2,
с той разницей, что при окрашивании клеток перед проведением
цитофлуориметрического анализа используют моноклональные конъюгированные с
соответствующими флуоресцентными красителями антитела против клеточных маркеров
мышиных иммунокомпетентных клеток.
6.3.6. Метод оценки
влияния наноматериалов на поликлональную активацию
лимфоцитов в реакции бласттрансформации лимфоцитов
Исследование проводят, как указано в МУ 1.2.2635-10
«Медико-биологическая оценка безопасности наноматериалов», п. 4.10.1, но без
добавления наноматериалов к тестируемым клеткам.
6.3.7 Оценка апоптоза
и пролиферативной активности методом
цитометрии с окраской пропидия йодидом
Исследование проводят с использованием образца спленоцитов
животных, как указано в МУ 1.2.2635-10 «Медико-биологическая оценка безопасности
наноматериалов», п. 4.11.3, но без добавления наноматериалов к тестируемым
клеткам.
6.3.8 Оценка влияния
наноматериалов на содержание
провоспалительных цитокинов (интерферона-гамма (IFN-γ) и
фактора некроза опухоли альфа (TNF-α) и общего белка
Определение количества IFN-γ/TNF-α в супернатанте
бронхолегочного лаважа животных (см. п. 6.1 настоящих
методических рекомендаций) производят с помощью иммуноферментных тест-систем на
основе биотин-авидинового иммунопероксидазного теста, аналогичного изложенному
в п. 5.3.5.
Дополнительным индикатором развития воспалительной реакции
является уровень общего белка в бронхолёгочном лаваже. Для его определения
используют спектрофотометрический метод Брэдфорда. Метод основан на реакции
красителя «кумасси» с аргинином и гидрофобными аминокислотными остатками белка.
Связанная форма имеет голубую окраску с максимумом поглощения при 595 нм.
100 мм3 бронхолёгочного лаважа смешивают со 100
мм3 красителя «кумасси», перемешивают и не менее чем через 5 мин, но
не больше, чем через 30 мин измеряют оптическую плотность на планшетном
фотометре при длине волны 595 нм (возможно использование светофильтра на 620
нм, но это несколько снижает чувствительность определения). Концентрацию белка
определяют по калибровочному графику, построенному с использованием растворов
БСА известной концентрации.
6.3.9.
Определение общих иммуноглобулинов A, G, М в сыворотке крови
Принцип метода основан на определении общих
иммуноглобулинов классов IgG, IgA и IgM в сыворотке крови у животных,
получавших наноматериалы с использованием двухвалентного твердофазного
иммуноферментного теста («сэндвич»-ИФА). Применяют готовые иммуноферментные
тест-системы производства «Sigma-Aldrich» (Германия) или другие с аналогичными
параметрами. В качестве варианта возможно проведение теста с использованием
метода, аналогичного разработанному для выявления стафилококкового
энтеротоксина (МУК
4.2.2429-08 «Метод определения стафилококковых энтеротоксинов в пищевых
продуктах»).
Ход реакции. Анализ проводят в две стадии. На первой
стадии калибровочные пробы с известной концентрацией IgG (А, М) и исследуемые
образцы инкубируют в лунках стрипированного планшета с иммобилизованными
моноклональными антителами (МКАТ) к IgG (А, М). На второй стадии связавшийся в
лунках IgG обрабатывают конъюгатом МКАТ против альтернативных эпитопов к IgG
(А, М) с пероксидазой (конъюгат МКАТ и иммобилизованные в лунках планшета МКАТ
специфичны к разным участкам молекулы IgG (А, М). После отмывания избытка
конъюгата образовавшиеся иммунные комплексы «иммобилизованные МКАТ1 - IgG (А,
М) - МКАТ2-пероксидаза» выявляют ферментативной реакцией с перекисью водорода и
хромогеном тетраметилбензидином. После остановки пероксидазной реакции
стоп-реагентом результаты учитывают фотометрически на планшетном фотометре при
двух длинах волн - основной (450 нм) и опорной (620 нм). Концентрацию IgG (А,
М) в пробах определяют по стандартному графику с использованием метода линейной
интерполяции (возможно использование программного обеспечения фотометра в
режиме «кусочной аппроксимации»).
6.3.10.
Оценка функциональной активности фагоцитов
Для исследований используют альвеолярные макрофаги (в
случае, если введение наноматериалов проводилась ингаляционно) или
перитонеальные макрофаги/нейтрофилы при введении животным наноматериалов
внутрижелудочно или парентерально.
6.3.10.1. Определение реакционноспособных форм кислорода в
реакциях спонтанной и индуцированной хемолюминесценции.
Принцип метода основан на способности фагоцитов
отвечать на стимуляцию опсонизированным зимозаном или ФМА реакцией
высвобождения РСК («респираторный взрыв»), регистрируемой по величине
хемолюминесценции в присутствии люминофора (люминол). Исследование проводят с
использованием образца перитонеальных или альвеолярных макрофагов животных, как
указано в МУ 1.2.2635-10 «Медико-биологическая оценка безопасности
наноматериалов» (п. 4.9.4), но без добавления наноматериалов к тестируемым
клеткам.
6.3.10.2. Определение фагоцитарной активности перитонеальных
нейтрофилов/макрофагов в НСТ-тесте.
Принцип метода заключается в способности
супероксидных радикалов, образующихся при активации фагоцитов, восстанавливать
нитро-синий тетразолий до образования нерастворимых окрашенных зерен
диформазана. Таким образом, по интенсивности накопления кристаллов диформазана
в цитоплазме можно судить об уровне синтеза супероксида, что является
показателем функциональной активности фагоцитов. Исследование проводят с
использованием образца перитонеальных или альвеолярных макрофагов животных, как
указано в МУ 1.2.2635-10 «Медико-биологическая оценка безопасности
наноматериалов» (п. 4.9.4), но без добавления наноматериалов к тестируемым
клеткам.
6.3.10.3. Оценка фагоцитарной активности фагоцитов
периферической крови.
Фагоцитарную активность фагоцитов (нейтрофильных лейкоцитов)
периферической крови животных определяют методом проточной цитофлуориметрии,
как описано в п. 5.3.2.
Оценку воздействия наночастиц/наноматериалов на показатели
функциональной активности клеток иммунной системы, определенные у
несенсибилизированных животных в системах ex vivo проводят на основании
следующих критериев:
а) однородность распределения показателя во всех тестируемых
группах животных, параметрический тест на остаточную дисперсию ANOVA;
б) факторный анализ с использованием параметрического теста
на остаточную дисперсию ANOVA по фактору воздействия наночастиц и
наноматериалов в группах животных, которым вводили и не вводили наночастицы и
наноматериалы;
в) парное сравнение животных контрольной группы и группы,
получавшей носитель с группами животных, которым вводили наноматериалы в
возрастающих концентрациях с использованием критериев непараметрической
статистики (тесты Манна-Уитни, Колмогорова-Смирнова) в целях выявления эффектов
наноматериала, в т.ч. дозозависимых.
При проведении статистической обработки рекомендуется
использовать профессиональные пакеты статистических программ.
Воздействие наночастиц/наноматериалов на показатели
функциональной активности клеток иммунной системы считается выявленным при
достоверности различия на уровне значимости Р = 0,05 и менее.
Обозначения и сокращения
АОК - антителообразующие клетки
БСА - бычий сывороточный альбумин
в/б - внутрибрюшинное (введение)
в/ж - внутрижелудочное (введение)
ИФА - иммуноферментный анализ
МКАТ - моноклональные антитела
НЛС - нормальная лошадиная сыворотка
ОВА - овальбумин куриного яйца
отн. ед. - относительные единицы
РСК - реакционноспособные формы кислорода
ФМА - форбол-12-миристат-13-ацетат
ФСБ - фосфатно-солевой буфер
ЭБ - эритроциты барана
ЭДТА - этилендиаминтетрауксусная кислота
7-AAD - 7-аминоактиномицин D
CD - клеточный антиген
FITC - флуоресцеинизотиоцианат
FL - флуоресценция
НЕРА - высокоэффективный воздушный фильтр
IFNγ - интерферон гамма
IL - интерлейкин(ы)
LD50 - доза, отвечающая 50 %
TNFα - летальности фактор некроза опухолей альфа
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)










