Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных
количеств
дифлубензурона в ягодах и соке черной
смородины методом высокоэффективной
жидкостной хроматографии
Методические
указания
МУК 4.1.3132-13
Москва
2014
1. Разработаны сотрудниками ГНУ «Всероссийский НИИ защиты
растений Россельхозакадемии» (В.И. Долженко, И.А. Цибульская, А.О. Берестецкий,
Е.В. Полуэктова); ГБОУ ДПО «Российская медицинская академия последипломного
образования» Минздрава России (М.С. Орлов).
2. Рекомендованы к утверждению Комиссией по государственному
санитарно-эпидемиологическому нормированию Федеральной службы по надзору в
сфере защиты прав потребителей и благополучия человека (протокол от 29 октября
2013 г. № 3).
3. Утверждены врио руководителя Федеральной службы по
надзору в сфере защиты прав потребителей и благополучия человека, Главного
государственного санитарного врача Российской Федерации А.Ю. Поповой 12 ноября
2013 г.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ
Врио
руководителя Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главного государственного санитарного
врача Российской Федерации
_______________________
А.Ю. Попова
12 ноября 2013 г.
|
4.1.
МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение
остаточных количеств дифлубензурона
в ягодах и соке черной смородины методом
высокоэффективной жидкостной хроматографии
Методические указания
МУК 4.1.3132-13
Свидетельство о метрологической
аттестации № 01.5.04.134/01.00043/2013.
Настоящие методические указания устанавливают порядок
применения метода высокоэффективной жидкостной хроматографии для определения массовой
концентрации дифлубензурона в ягодах и соке черной смородины в диапазоне
концентраций 0,001 - 0,01 мг/кг.
Методические указания носят рекомендательный характер.
Название действующего вещества по ИСО: дифлубензурон.
Название действующего вещества по ИЮПАК:
1-(4-хлорфенил)-3-(2,6-дифторбензоил)мочевина.
N-{[(4-хлорфенил)амино]карбонил}-2,6-дифторбензамид
(С.А.).
Структурная формула:
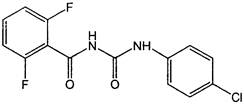
Эмпирическая формула: C14H9ClF2N2O2.
Молекулярная масса: 310,7.
Бесцветное кристаллическое вещество (технический - кристаллы
от белых до желтых).
Температура плавления: 228 °С (техн.: 210 - 230 °С).
Давление паров при 25 °С: 1,2×10-4 мПа.
Коэффициент распределения н-октанол/вода: Kow log
Р = 3,89.
Растворимость (г/л) при 20 °С: н-гексан - 0,063, толуол -
0,29, дихлорметан - 1,8, метанол - 1,1, вода - 0,08 мг/л (при pH 7 и 25 °С).
Вещество стабильно в кислых средах (20 °С, pH 5 - 7, DT50
> 150 дней), разлагается в щелочных растворах (при pH 9 DT30 42
дня).
Краткая токсикологическая характеристика: Острая
пероральная токсичность (LD50) для мышей и крыс - более 4640 мг/кг;
острая дермальная токсичность (LD50) для кроликов - более 2000
мг/кг, для крыс - более 10000 мг/кг; острая ингаляционная токсичность (LC50)
для крыс -более 2,88 мг/л. Токсичен для пчел. СК50 для рыб 130 - 150
мг/л при экспозиции 96 ч.
Мутагенный и онкогенный эффекты при использовании препарата
не наблюдались.
Гигиенические нормативы для дифлубензурона в России в ягодах
и соке черной смородины не установлены.
Область применения: Несистемный регулятор роста
насекомых с контактным и кишечным действием. Используется для уничтожения
широкого диапазона насекомых-вредителей, питающихся листьями лесных и плодовых
деревьев, а также плодами. Эффективен против яблонной плодожорки, листоверток и
др.
При соблюдении всех регламентированных условий проведения
анализа в точном соответствии с данной методикой погрешность (и ее
составляющие) результатов измерений при доверительной вероятности Р =
0,95 не превышает значений, приведенных в табл. 1.
для соответствующих диапазонов концентраций.
Таблица 1
Метрологические параметры
|
Объект анализа
|
Диапазон
определяемых концентраций, мг/кг (мг/дм3)
|
Показатель
повторяемости (относительное среднеквадратическое отклонение повторяемости),
σr, %
|
Показатель
внутрилабораторной прецизионности, σRл,
%
|
Показатель
воспроизводимости, σR, %
|
Показатель
точности* (границы относительной погрешности), ±δ, %
|
|
Ягоды
|
0,001
- 0,01
|
9
|
11
|
12
|
24
|
|
Сок
|
0,001
- 0,01
|
9
|
11
|
12
|
24
|
|
*Соответствует расширенной
неопределенности Uотн. при коэффициенте охвата k = 2
|
Таблица 2
Полнота извлечения дифлубензурона, стандартное отклонение,
доверительный интервал среднего результата для n
= 20, Р = 0,95
|
Анализируемый объект
|
Предел
обнаружения, мг/кг (мг/дм3)
|
Диапазон
определяемых концентраций, мг/кг (мг/дм3)
|
Полнота извлечения, %
|
Стандартное
отклонение, S
|
Доверительный
интервал среднего результата, ± %
|
|
Ягоды
|
0,001
|
0,001 - 0,01
|
89,9
|
4,6
|
2,0
|
|
Сок
|
0,001
|
0,001 - 0,01
|
92,0
|
4,2
|
1,8
|
Методика основана на определении дифлубензурона методом высокоэффективной
жидкостной хроматографии (ВЭЖХ) с ультрафиолетовым детектором после его
извлечения из образцов ацетонитрилом и очистке экстрактов на патронах для
твердофазной экстракции (ТФЭ).
Идентификация дифлубензурона проводится по времени
удерживания, количественное определение - методом абсолютной калибровки.
Избирательность метода обеспечивается сочетанием условий
подготовки проб и хроматографирования.
3.1. Средства измерений
|
Жидкостный
хроматограф с быстросканирующим ультрафиолетовым детектором, снабженный
дегазатором, автоматическим пробоотборником и термостатом колонки
|
|
|
Весы
аналитические с пределом взвешивания до 210 г и пределом допустимой
погрешности 0,2 мг
|
ГОСТ
24104-01
|
|
Весы
технические с пределом взвешивания до 400 г и допустимой погрешностью 0,1 г
|
ГОСТ
24104-01
|
|
Колбы
мерные на 10, 100 и 1000 см3
|
ГОСТ
23932-90
|
|
Микродозаторы
одноканальные переменного объема от 200 до 1000 мм3 и от 1 до 5 см3
|
|
|
Цилиндры
мерные на 50 и 100 см3
|
ГОСТ
23932-90
|
Примечание. Допускается использование средств измерения с
аналогичными или лучшими характеристиками.
3.2.
Реактивы
|
Ацетонитрил,
хч
|
ТУ
6-09-3534-87
|
|
Вода
бидистиллированная, деионизированная
|
ГОСТ
Р 52501-05
|
|
Дифлубензурон,
аналитический стандарт 99,9 %
|
|
|
Диэтиловый
эфир, ч
|
ГОСТ
84-2006-88
|
|
н-Гексан,
хч
|
ТУ 2631-003-05807999-98
|
|
Подвижная
фаза для ВЭЖХ: смесь ацетонитрил-вода (60:40, по объему).
|
|
|
Элюент
№ 1: смесь вода-ацетонитрил (60:40, по объему)
|
|
|
Элюент
№ 2: смесь гексан-диэтиловый эфир (80:20, по объему)
|
|
|
Элюент №
3: смесь гексан-диэтиловый эфир (55:45, по объему)
|
|
|
Элюент
№ 4: смесь вода-ацетонитрил (70:30, по объему)
|
|
Примечание. Допускается использование реактивов с более высокой
квалификацией, не требующих дополнительной очистки растворителей.
3.3. Вспомогательные устройства и материалы
|
Аналитическая
колонка, заполненная сорбентом с привитыми монофункциональными полярными
группами С18, (100×2,1) мм, 1,7 мкм
|
|
|
Аппарат
для встряхивания проб
|
ТУ 64-1-1081-73
|
|
Вакуумный
водоструйный насос
|
ГОСТ
10696-75
|
|
Воронки
химические конусные
|
ГОСТ
25336-82
|
|
Колбы
круглодонные на шлифе вместимостью 50 и 100 см3
|
ГОСТ
9737-93
|
|
Колбы
плоскодонные конические вместимостью 100 см3
|
ГОСТ
25336-82
|
|
Патроны
для ТФЭ с привитыми гексадецильными группами, 0,4 г
|
|
|
Патроны
для ТФЭ на основе силикагеля с постоянной активностью, 0,4 г
|
|
|
Пробирки
полипропиленовые центрифужные с крышками объемом 50 см3
|
|
|
Ротационный
вакуумный испаритель с мембранным насосом, обеспечивающим вакуум до 10 мбар
|
|
|
Ультразвуковая
ванна с рабочей частотой 35 кГц
|
|
|
Центрифуга
с максимальной рабочей частотой вращения 4000 об./мин.
|
|
Примечание: Допускается применение оборудования с аналогичными
или лучшими техническими характеристиками.
4.1. При выполнении измерений необходимо соблюдать
требования техники безопасности при работе с химическими реактивами по ГОСТ
12.1.007-76, требования по электробезопасности при работе с
электроустановками по ГОСТ
12.1.019-09, а также требования, изложенные в технической документации на
жидкостный хроматограф.
4.2. Помещение лаборатории должно быть оборудовано
приточно-вытяжной вентиляцией, соответствовать требованиям пожарной
безопасности по ГОСТ
12.1.004-91 и иметь средства пожаротушения по ГОСТ
12.4.009-83. Содержание вредных веществ в воздухе не должно превышать ПДК
(ОБУВ), установленные ГН
2.2.5.1313-03 и 2.2.5.2308-07.
Организация обучения работников безопасности труда - по ГОСТ
12.0.004-90.
Измерения в соответствии с настоящей методикой может
выполнять специалист-химик, имеющий опыт работы методом высокоэффективной
жидкостной хроматографии, ознакомленный с руководством по эксплуатации
хроматографа, освоивший данную методику и подтвердивший экспериментально
соответствие получаемых результатов нормативам контроля погрешности измерений
по п. 13.
При выполнении измерений выполняют следующие условия:
- процессы приготовления растворов и подготовки проб к
анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности
не более 80 %;
- выполнение измерений на жидкостном хроматографе проводят в
условиях, рекомендованных технической документацией к прибору.
7.1. Кондиционирование колонки
Перед началом анализа колонку кондиционируют в потоке
подвижной фазы (0,1 - 0,2 см3/мин) до стабилизации нулевой линии.
7.2.
Приготовление растворов
7.2.1. Для приготовления элюента № 1 смешивают
в мерной колбе на 100 см3 40 см3 ацетонитрила и 60 см3
бидистиллированной воды, используя мерные цилиндры.
7.2.2. Для приготовления элюента № 2 смешивают
в мерной колбе на 100 см3 80 см3 гексана и 20 см3
диэтилового эфира, используя мерные цилиндры.
7.2.3. Для приготовления элюента № 3 смешивают
в мерной колбе на 100 см3 55 см3 гексана и 45 см3
диэтилового эфира, используя мерные цилиндры.
7.2.4. Для приготовления элюента № 4 смешивают
в мерной колбе на 100 см3 30 см3 ацетонитрила и 70 см3
бидистиллированной воды, используя мерные цилиндры.
7.2.5. Для приготовления подвижной фазы в
мерную колбу на 1 дм3 вносят 600 см3 ацетонитрила и
доводят водой объем раствора до метки, встряхивая в течение 2 мин.
7.3.
Приготовление основного и градуировочных растворов
7.3.1. Основной раствор с концентрацией 0,5 мг/см3:
точную навеску дифлубензурона (50 ± 0,5) мг помещают в мерную колбу
вместимостью 100 см3, растворяют в ацетонитриле и доводят объем до
метки ацетонитрилом.
Градуировочные растворы с концентрациями дифлубензурона 0,1;
0,2; 0,5; 1,0 мкг/см3 готовят методом последовательного разбавления
по объему, используя раствор подвижной фазы (смесь ацетонитрил-вода в
соотношении 60:40).
7.3.2. Раствор № 1 с концентрацией 1,0 мкг/см3:
в мерную колбу вместимостью 100 см3 вносят 0,2 см3
основного раствора и доводят до метки подвижной фазой.
7.3.3. Раствор № 2 с концентрацией 0,5 мкг/см3:
в мерную колбу вместимостью 10 см3 помещают 5,0 см3
раствора № 1 и доводят объем до метки подвижной фазой.
7.3.4. Раствор № 3 с концентрацией 0,2 мкг/см3:
в мерную колбу вместимостью 10 см3 помещают 2 см3
раствора № 1 и доводят объем до метки подвижной фазой.
7.3.5. Раствор № 4 с концентрацией 0,1 мкг/см3:
в мерную колбу вместимостью 10 см3 помещают 1 см3
раствора № 1 и доводят объем до метки подвижной фазой.
Основной раствор можно хранить в холодильнике при
температуре 0 - 4 °С в течение 1 месяца, градуировочные растворы - в течение
суток.
При изучении полноты извлечения дифлубензурона в ягодах и
соке смородины используют ацетонитрильные растворы вещества, приготовленные из
основного раствора методом последовательного разбавления по объему
ацетонитрилом.
7.4.
Построение градуировочного графика
Для построения градуировочного графика (площадь пика -
концентрация дифлубензурона в растворе) в хроматограф вводят по 10 мм3
градуировочных растворов (не менее 3 параллельных измерений для каждой
концентрации, не менее 4 точек по диапазону измеряемых концентраций). Затем
измеряют площади пиков и строят график зависимости среднего значения площади
пика от концентрации дифлубензурона в градуировочном растворе.
Методом наименьших квадратов
рассчитывают градуировочный коэффициент (K) в
уравнении линейной регрессии:
S - площадь пика
градуировочного раствора.
Градуировку признают удовлетворительной, если значение коэффициента
линейной корреляции оказывается не ниже 0,99.
Градуировочную характеристику необходимо проверять при
замене реактивов, хроматографической колонки или элементов хроматографической
системы, а также при отрицательном результате контроля градуировочного
коэффициента.
Градуировочную зависимость признают стабильной при
выполнении следующего условия:
С - аттестованное значение
массовой концентрации дифлубензурона в градуировочном растворе;
Сk - результат контрольного измерения массовой концентрации
дифлубензурона в градуировочном растворе;
λконтр. -
норматив контроля градуировочного коэффициента, %. (λконтр.
= 10 % при Р = 0,95).
7.5. Проверка хроматографического поведения дифлубензурона
на патроне на основе силикагеля с постоянной активностью
Патрон кондиционируют последовательно промывая элюентом № 3
и гексаном (по 6 см3). В испарительную колбу емкостью 50 см3
отбирают 0,1 см3 раствора дифлубензурона в ацетонитриле концентрации
10 мкг/см3, добавляют 3 см3 элюента № 2 и помещают колбу
в ультразвуковую ванну на 2 мин. Раствор вносят в кондиционированный патрон.
Колбу обмывают 3 см3 элюента № 2 и также вносят в патрон. Затем
патрон промывают 6 см3 элюента № 3. Отбирают фракции по 3 см3
каждая, упаривают, сухой остаток растворяют в 2 см3 подвижной фазы
для ВЭЖХ в ультразвуковой ванне (10 с) и анализируют на содержание
дифлубензурона по п. 9.3.
Фракции, содержащие дифлубензурон, объединяют, упаривают
досуха, остаток растворяют в 2 см3 подвижной фазы для ВЭЖХ и вновь
анализируют по п. 9.3. Рассчитывают
содержание дифлубензурона в элюате, определяя полноту вымывания вещества и
необходимый для очистки экстракта объем элюента.
7.6. Проверка хроматографического поведения дифлубензурона
на патроне с гидрофобным сорбентом с привитыми
гексадецильными группами
Кондиционирование патрона проводят также, как описано в п. 7.5. В круглодонную колбу емкостью 50 см3
вносят 10 см3 воды, добавляют 0,1 см3 раствора
дифлубензурона в ацетонитриле концентрации 10 мкг/см3, перемешивают
и полученную смесь вносят в кондиционированный патрон. Патрон промывают 6 см3
элюента № 4 и 6 см3 ацетонитрила. Отбирают фракции по 3 см3
каждая, упаривают, остаток растворяют в 2 см3 подвижной фазы для
ВЭЖХ в ультразвуковой ванне (10 с) и анализируют на содержание дифлубензурона
по п. 9.3. Фракции, содержащие
дифлубензурон, объединяют, упаривают досуха, остаток растворяют в 2 см3
подвижной фазы для ВЭЖХ и вновь анализируют по п. 9.3. Рассчитывают содержание дифлубензурона в элюате,
определяя полноту вымывания вещества и необходимый для очистки экстракта объем
элюента.
Примечание: профиль вымывания дифлубензурона с патрона может
меняться при использовании новой партии патронов и растворителей.
7.7.
Подготовка приборов и средств измерения
Установка и подготовка всех приборов и средств измерения
проводится в соответствии с требованиями технической документации.
Отбор проб производится в соответствии с «Унифицированными
правилами отбора проб сельскохозяйственной продукции, продуктов питания и
объектов окружающей среды для определения микроколичеств пестицидов» (№ 2051-79
от 21.08.79), а также в соответствии с ГОСТ
6829-89 (СТ СЭВ 6534-88) «Смородина черная свежая. Требования при
заготовках, поставках и реализации».
9.1. Определение дифлубензурона в ягодах смородины
9.1.1 Экстракция. Для экстракции дифлубензурона
навеску массой (10 ± 0,1) г ягод помещают в пробирку емкостью 50 см3,
добавляют 30 см3 ацетонитрила, измельчают, перемешивают 1 - 2 мин
вручную либо на встряхивателе, центрифугируют 10 мин при 4000 об./мин,
супернатант декантируют в мерный цилиндр на 100 см3. Экстракцию
повторяют два раза. Объем объединенных растворов доводят ацетонитрилом до 100
см3. Для последующего анализа отбирают 20 см3 раствора
(или аликвоту 20 % экстракта) и переносят в испарительную колбу объемом 50 см3.
Растворитель упаривают из полученного раствора на роторном испарителе при
температуре не выше 40 °С. Дальнейшую очистку экстракта проводят по пунктам 9.1.2. и 9.1.3.
9.1.2. Очистка на патроне с привитыми
гексадецильными группами. Экстракт растворяют в 2 см3
ацетонитрила и добавляют 8 см3 воды. Кондиционируют патрон, как
описано в п. 7.5, и вводят в него
экстракт (скорость потока не более 2 мл/мин). Обмывают колбу с остатком
экстракта элюентом № 4 (6 см3), промывают патрон этим раствором,
элюат отбрасывают. Патрон подсушивают током воздуха 1 мин. Аналит смывают в
испарительную колбу объемом 50 см3 ацетонитрилом (объем 3 см3).
Растворитель отгоняют из полученного раствора на роторном испарителе при
температуре не выше 40 °С. Далее очистку экстракта проводят по п. 9.1.3.
9.1.3. Очистка на патроне с
гидрофильным сорбентом с постоянной активностью. Патрон кондиционируют
по п. 7.5. Экстракт, очищенный по п. 9.1.2, растворяют в 2 см3
элюента № 2 и вносят в кондиционированный патрон. Колбу обмывают 5 см3
элюента № 2 и также вносят в патрон. Элюат отбрасывают. Аналит смывают элюентом
№ 3 (3 см3) в испарительную колбу объемом 50 см3.
Растворитель упаривают из полученного раствора на роторном испарителе при
температуре не выше 40 °С.
Для проведения анализа растворяют сухой остаток в 1,2 см3
ацетонитрила в ультразвуковой ванне (10 с) и добавляют 0,8 см3 воды.
После перемешивания в ультразвуковой ванне (10 с) 10 мм3 раствора
вводят в хроматограф и проводят анализ по п. 9.3.
9.2.
Определение дифлубензурона в соке смородины
Патрон с привитыми гексадецильными группами кондиционируют
как описано в п. 7.6 и вводят в него 2
см3 сока (скорость вытекания раствора с патрона должна быть не более
2 см3/мин). Промыть колбу с остатком сока и картридж 6 см3
элюента № 4. Патрон подсушивают током воздуха 1 мин. Аналит смывают в
испарительную колбу объемом 50 см3 ацетонитрилом (объем 3 см3).
Растворитель упаривают из полученного раствора на роторном испарителе при
температуре не выше 40 °С.
Для проведения анализа растворяют сухой остаток в 1,2 см3
ацетонитрила в ультразвуковой ванне (10 с) и добавляют 0,8 см3 воды.
После перемешивания в ультразвуковой ванне (10 с) 10 мм3 раствора
вводят в хроматограф и проводят анализ по п. 9.3.
9.3. Условия хроматографирования
Ультраэффективный жидкостной хроматограф с быстросканирующим
ультрафиолетовым детектором, снабженный дегазатором, автоматическим
пробоотборником и термостатом колонки. Аналитическая колонка, заполненная
сорбентом с привитыми монофункциональными полярными группами С18,
(100×2,1) мм, 1,7 мкм. Температура колонки (30 ± 1) °С. Подвижная фаза:
смесь ацетонитрила и воды в соотношении 60:40 (по объему). Скорость потока
элюента: 0,25 см3/мин. Рабочая длина волны ультрафиолетового
детектора 260 нм. Объем вводимой пробы 10 мм3.
Количественное определение
проводят методом абсолютной калибровки, содержание дифлубензурона в пробе (X,
мг/кг) вычисляют по формуле:
Sx - площадь пика
дифлубензурона на хроматограмме испытуемого образца, мм2 (AU);
K - градуировочный
коэффициент, найденный на стадии построения соответствующей градуировочной
зависимости;
V -
объём пробы, подготовленной для хроматографического анализа, см3;
Р - навеска анализируемого образца, г;
f -
полнота извлечения дифлубензурона, приведенная в табл. 2, %.
Содержание остаточных количеств дифлубензурона в
анализируемом образце вычисляют как среднее из 2 параллельных определений.
Образцы, дающие пики большие, чем стандартный раствор
дифлубензурона 1 мкг/см3, разбавляют подвижной фазой.
11.
Проверка приемлемости результатов
параллельных определений
За результат анализа принимают
среднее арифметическое результатов двух параллельных определений, расхождение
между которыми не превышает придел повторяемости:
|
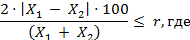
|
(1)
|
X1, Х2
- результаты параллельных определений, мг/кг;
r - значение предела
повторяемости (r = 2,8σr).
При невыполнении условия (1)
выясняют причины превышения предела повторяемости, устраняют их и вновь
выполняют анализ.
Результат анализа представляют в виде:
(![]() ± Δ) мг/кг при вероятности Р
= 0,95, где
± Δ) мг/кг при вероятности Р
= 0,95, где
![]() - среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
- среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
Δ - граница абсолютной
погрешности, мг/кг:
δ - граница
относительной погрешности методики (показатель точности в соответствии с
диапазоном концентраций), %.
В случае, если содержание компонента менее нижней границы
диапазона определяемых концентраций, результат анализа представляют в виде:
содержание вещества в пробе «менее нижней границы
определения» (например: менее 0,001 мг/кг*, где * - 0,001 мг/кг - предел
обнаружения дифлубензурона в ягодах смородины).
13.
Контроль качества результатов измерений
Оперативный контроль погрешности и воспроизводимости
измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1-6-02
«Точность (правильность и прецизионность) методов и результатов измерений».
13.1. Стабильность результатов измерений контролируют перед
проведением измерений, анализируя один из градуировочных растворов.
13.2. Плановый внутрилабораторный оперативный контроль
процедуры выполнения анализа проводится с применением метода добавок.
Величина добавки С∂
должна удовлетворять условию:
±Δл, Х,
(±Δл, Хʹ) - характеристика погрешности (абсолютная
погрешность) результатов анализа, соответствующая содержанию компонента в
испытуемом образце (расчетному значению содержания компонента в образце с
добавкой соответственно), мг/кг;
при этом:
Δ - граница абсолютной погрешности, мг/кг:
δ - граница
относительной погрешности методики (показатель точности в соответствии с
диапазоном концентраций), %.
Результат контроля процедуры Kk рассчитывают по формуле:
Xʹ, X, С∂
- среднее арифметическое результатов параллельных определений (признанных
приемлемыми по п. 11)
содержания компонента в образце с добавкой, испытуемом образце, концентрация
добавки соответственно, мг/кг.
Норматив контроля K рассчитывают по формуле:
Проводят сопоставление результата
контроля процедуры (Kk) с нормативом
контроля (K).
Если результат контроля
процедуры удовлетворяет условию
процедуру анализа
признают удовлетворительной.
При невыполнении условия (2)
процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным
результатам, и принимают меры к их устранению.
13.3. Проверка приемлемости результатов измерений,
полученных в условиях воспроизводимости.
Расхождение между результатами
измерений, выполненных в двух разных лабораториях, не должно превышать предел
воспроизводимости (R):
|
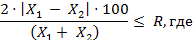
|
(3)
|
X1, Х2
- результаты измерений в двух разных лабораториях, мг/кг;
R - предел воспроизводимости (в соответствии с
диапазоном концентраций), %.
Определение остаточных количеств дифлубензурона в ягодах и
соке черной смородины методом высокоэффективной жидкостной хроматографии
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)



