ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ГИДРОМЕТЕОРОЛОГИИ И
МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ (РОСГИДРОМЕТ)
|
РУКОВОДЯЩИЙ ДОКУМЕНТ
|
РД 52.24.670-2005
|
УНИФИЦИРОВАННЫЙ МЕТОД
ОПРЕДЕЛЕНИЯ
ОСТРОЙ ТОКСИЧНОСТИ ПРОБ
ПОВЕРХНОСТНЫХ ВОД СУШИ,
СОДЕРЖАЩИХ ВЗВЕШЕННЫЕ ВЕЩЕСТВА
Предисловие
1
РАЗРАБОТАН ГУ «ГХИ» Федеральной службы по гидрометеорологии и мониторингу
окружающей среды (Росгидромет)
2
РАЗРАБОТЧИКИ А.М. Никаноров, чл.-корр. РАН, руководитель разработки; Н.М. Трунов,
канд. техн. наук; Л.М. Федотова.
3
УТВЕРЖДЕН Заместителем Руководителя Росгидромета 13.12.2005 г.
4
ЗАРЕГИСТРИРОВАН ГУ ЦКБ ГМП за номером РД 52.24.670-2005 от 28.12.2005 г.
5
ВВЕДЕН ВПЕРВЫЕ
СОДЕРЖАНИЕ
РУКОВОДЯЩИЙ ДОКУМЕНТ
|
УНИФИЦИРОВАННЫЙ МЕТОД
ОПРЕДЕЛЕНИЯ ОСТРОЙ ТОКСИЧНОСТИ ПРОБ
ПОВЕРХНОСТНЫХ ВОД СУШИ, СОДЕРЖАЩИХ ВЗВЕШЕННЫЕ ВЕЩЕСТВА
|
Дата введения - 2006-07-01
Настоящий
руководящий документ устанавливает порядок определения острой токсичности
водной среды в условиях опасного уровня загрязнения поверхностных вод суши,
содержащих взвешенные вещества с помощью биотеста токсичности на основе
фильтрационной активности инфузорий Paramecium caudatum.
Данный документ предназначен для
оперативно-производственных подразделений территориальных управлений по
гидрометеорологии и мониторингу окружающей среды (УГМС) Росгидромета,
осуществляющих организацию и проведение оперативных наблюдений за состоянием
аварийно загрязненных поверхностных вод суши.
Кроме этого
документ может быть использован в сетевых подразделениях осуществляющих
организацию и проведение режимных наблюдений за состоянием поверхностных вод
суши в рамках Государственной службы наблюдений России в соответствии с
правилами охраны поверхностных вод суши [1].
В настоящем
документе использованы ссылки на следующие нормативные документы:
ГОСТ
17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод.
Основные термины и определения.
ГОСТ
17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора,
первичной обработки и хранения проб природных вод. Общие технические условия.
ГОСТ
17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб
поверхностных и морских вод, льда и атмосферных осадков.
ГОСТ
1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы,
пробирки. Общие технические условия.
ГОСТ
9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия.
ГОСТ
12026-76 Бумага фильтровальная лабораторная. Технические условия.
ГОСТ
24104-2001 Весы лабораторные общего назначения и образцовые. Общие
технические условия.
ГОСТ
25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные
параметры и размеры.
ГОСТ 27065-86
Качество вод. Термины и определения.
ГОСТ 29169-91
Посуда лабораторная стеклянная. Пипетки с одной отметкой.
ГОСТ
29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1.
Общие требования.
ГОСТ Р 51592-2000
Вода. Общие требования к отбору проб.
РД
52.24.309-92. Организация и проведение режимных наблюдений за загрязнением
поверхностных вод суши на сети Роскомгидромета.
Р 52.24.566-94
Рекомендации. Методы токсикологической оценки загрязнения пресноводных
экосистем.
РД
52.44.2-94. Методические указания. Охрана природы. Комплексное обследование
загрязнения природных сред промышленных районов с интенсивной антропогенной
нагрузкой.
ТУ 6-89
5ж2.840.050. Флуориметр «Квант-7».
ТУ 3-3.1210
Микроскоп бинокулярный, стереоскопический с увеличением 3,6 - 100,1 марки МБС.
В настоящем
руководящем документе использованы следующие термины и определения:
3.1
биологическое тестирование: Оценка качества воды по ответным реакциям водных
организмов, являющихся тест-объектами [по ГОСТ 27065 (СТ СЭВ 6184)].
3.2 биотест:
Совокупность приемов получения информации о токсичности воды (донных
отложений) на основе регистрации реакций тест-объекта.
3.3 тест-объекты:
Используемые при биотестировании гидробионты. В настоящих документах
инфузории Paramecium caudatum. (P 52.24.566).
3.4 острое токсическое
действие (острая токсичность): Воздействие, вызывающее быструю ответную
реакцию тест-объекта.
3.5 фильтрационная активность тест-объекта: Количественная
характеристика скорости поглощения пищи тест-объектами. В настоящих документах
- инфузории Paramecium caudatum.
3.6 пробный
корм: Искусственно приготовленная суспензия яркофлуоресцирующих пластиковых
микрочастиц, размерами, формой, а также числом частиц в единице объема,
имитирующая естественный дрожжевой корм тест-организмов.
3.7 пробное
кормление: Замена естественного корма тест-объекта (дрожжевых или
бактериальных клеток) искусственно приготовленным пробным кормом, позволяющим
количественно контролировать скорость потребления пищи тест-объектом.
3.8 экспозиция:
Время, в течение которого тест-объект находится под воздействием
исследуемого фактора. В зависимости от длительности экспозиции различают острое
или хроническое токсическое действие (РД 52.24.635).
4.1 Для разработки
унифицированных методов обнаружения опасных уровней загрязнения поверхностных
вод суши в данном документе используется флуориметрический метод определения
фильтрационной активности инфузорий Paramecium caudatum
(РД
52.44.2, [2] - [4]). При этом под унификацией
метода понимается:
а) возможность
применения метода, в одном и том же варианте, как для контроля острой
токсичности растворенных в воде загрязняющих веществ, так и для контроля острой
токсичности загрязняющих веществ, сорбированных на взвешенных частицах;
б) возможность
применения метода, в одном и том же варианте при использовании различных
тест-объектов.
4.2 Метод
основан на количественной оценке реакции биотеста с помощью флуориметрического
измерения концентрации пробного корма в опытной и контрольной серии. В роли
тест-объекта могут быть использованы гидробионты-фильтраторы, добывающие пищу
путем фильтрации её из окружающей водной среды. В этом случае загрязняющие
вещества, растворенные в воде попадают внутрь организма обычным путем через
систему дыхания, а загрязняющие вещества сорбированные на взвешенных частицах
попадают в пищеварительную систему тест-организмов и обнаруживаются по своему
воздействию на фильтрационную активность тест-организмов. Одним из наиболее
удобных тест-объектов являются повсеместно распространенные свободноживущие
инфузории Paramecium caudatum, включенные в списки
унифицированных методов стран СЭВ в качестве тест-организмов.
5.1 Метод
тестирования острой токсичности основан на сравнении величин фильтрационной
активности тест-организмов в опыте и контроле, выявляемой в результате пробного
кормления.
5.2 Оценку
острой токсичности производят путем сопоставления результатов действия
тестируемой и контрольной воды на инфузорий после экспозиции длительностью до 6
ч.
5.3 В качестве
пробного корма используют суспензию в культуральной среде микроскопических
пластиковых микросфер, приготовленных из яркофлуоресцирующих инертных
материалов, размерами и формой, имитирующих природный корм тест-объекта
(дрожжевые клетки).
5.4 Критерием
наличия токсического воздействия тестируемой воды на тест-организмы является
статистически значимое изменение фильтрационной активности, измеряемой по
остаточной флуоресценции культуральной жидкости у опытных и контрольных
организмов после пробного кормления.
5.5
Длительность пробного кормления инфузорий составляет 30 мин, после чего опытные
и контрольные организмы отлавливают и удаляют, а интенсивность флуоресценции
опытной и контрольной культуральных сред измерить на флуориметре «Квант-7».
6.1 Флуориметр
«Квант-7» по ТУ 6-89 5ж2.840.050
6.2 Микроскоп
бинокулярный стереоскопический с увеличением 3,6 - 100,1 марки МБС, по ТУ
3-3.1210
6.3 Стаканы
химические тип В, Н по ГОСТ
25336, вместимостью 100 см3
6.4 Пипетки с
одной отметкой по ГОСТ 29169
6.5 Пипетки
градуированные не ниже 2 класса точности исполнения 2 по ГОСТ
29227, вместимостью 1 см3 и 5 см3
6.6 Пробирки (с
пришлифованными пробками), по ГОСТ
1770, вместимостью 10 см3
6.7 Стеклянные
капилляры (см. п. 10.2)
6.9 Суспензия яркофлуоресцирующих пластиковых микрочастиц,
размерами, формой частиц, а также числом частиц в единице объема, имитирующая
естественный дрожжевой корм тест-организмов (производится Гидрохимическим
институтом Росгидромета).
7.1 Отбор проб
производят в соответствии с ГОСТ
17.1.5.05 и ГОСТ
Р 51592.
7.2 Отбор проб
осуществляют батометром (ГОСТ
17.1.5.04), объем пробы для определения острого токсического действия - 0,5
дм3.
7.3 Отобранную
пробу воды транспортируют и хранят в стеклянной или полиэтиленовой посуде, не
консервируя (Р 52.24.566).
8.1 При отборе
проб и биотестировании загрязненных поверхностных вод суши необходимо соблюдать
правила, утвержденные в установленном порядке инструкциями по работе на водных
объектах и в химических лабораториях с вредными веществами.
8.2 Особых
требований по экологической безопасности не предъявляют.
8.3 К работе по
биотестированию допускают лиц, освоивших методы водной токсикологии, методы
полевых и лабораторных исследований с помощью биотестов и прошедших инструктаж
по технике безопасности.
9.1
Биотестирование осуществляют в нестерильных условиях в помещении или боксе, в
которых отсутствуют токсические пары или газы. Оптимальная температура
тестируемой воды (20 ± 2) °С.
9.2 Посуда, используемая
для отбора проб, культивирования инфузорий и тестирования должна быть тщательно
вымыта, ополоснута дистиллированной водой и высушена в сушильном шкафу. Для
мытья посуды используют хромовую смесь и бикарбонат натрия. Органические
растворители и поверхностно-активные вещества для мытья посуды применять
нельзя. Приготовленная таким образом посуда, а также материалы и реактивы
запаивают в полиэтиленовые пакеты, которые вскрываются непосредственно перед
употреблением предметов на месте работы.
9.3 Подготовку
к работе и поверку флуориметра осуществляют в соответствии с технической
документацией на прибор.
10.1 Культуру
инфузорий Paramecium caudatum используют в стадии
стационарного роста, в связи с чем приготовление рабочей культуры осуществляют
заранее за 5 - 7 дней до процедуры тестирования. Условия культивирования
приведены в приложении А.
10.2
Стеклянные капилляры, необходимые для отлавливания инфузорий, готовят вручную из
стеклянных трубочек диаметром 3 - 5 мм. При этом на пламени спиртовки трубки
нагревают и вытягивают до меньшего диаметра 0,2 - 0,3 мм. После чего вытянутый
кончик капилляра шлифуют наждачной бумагой (нулевкой) и оплавляют в пламени
спиртовки.
11.1 С целью
выявления формы нахождения токсических агентов тестируют фильтрованные и
фильтрованные через мембранный фильтр (диаметр пор 0,45 мкм) пробы загрязненных
поверхностных вод суши или серии их разбавлений. В каждой серии тестируют не
менее 3 разбавлений с коэффициентом от 2 до 10, разбавления готовят
непосредственно перед процедурой биотестирования, при этом учитывают
дополнительное разбавление за счет внесения вместе с тест-организмами
культуральной среды.
11.2 Для
разбавлений и контроля используют дехлорированную (отстоянную в течение 5
суток) воду из водопровода.
11.3 Количество
особей, используемое в каждом опыте, не менее 50 шт., поэтому для
экспонирования берут по 5 см3 плотной культуры инфузорий (в опыт и в
контроль), переносят в стаканы, после чего объем жидкости в опытном и
контрольном стакане доводят до 50 см3. При этом в опытный стакан
доливают тестируемую воду, а в контрольный - дехлорированную отстоянную.
11.4 Длительность
экспозиции тест-объектов в тестируемых средах от 2 до 6 ч, после чего из
каждого опытного и контрольного стакана с помощью стеклянных капилляров под
микроскопом МБС-1 отлавливают по 50 инфузорий и переносят в мерные пробирки,
при этом следят за тем, чтобы конечный объем жидкости в пробирках с
отловленными инфузориями был равен 10 см3.
11.5 В пробирки
с отловленными инфузориями добавляют с помощью пипетки 0,1 см3
пробного корма.
11.6 По
истечении времени кормления, которое составляет 30 мин, из каждой пробирки с
помощью чистого капилляра набирают 3 см3 среды без инфузорий.
11.7 Отобранную
среду помещают в кюветы флуориметра «Квант-7» после чего производят измерение
интенсивности флуоресценции на длине максимума флуоресценции пробного корма.
11.8 Каждое
измерение на флуориметре выполняют не менее 10 раз после чего рассчитывают
среднее арифметическое значение.
11.9
Температуру тестируемых сред и в опыте, и в контроле поддерживают близкой к
температуре культивирования тест-объектов (20 ± 1) °С.
12.1 В рабочий
журнал заносят дату проведения тестирования, номер пробы, номер опыта,
результаты измерения интенсивности флуоресценции на флуориметре «Квант-7» и
примечания.
12.2 Определение
достоверности отклонений опытов от контроля осуществляют с помощью t -
критерия Стьюдента. Для этого рассчитывают эмпирическое значение критерия
Стьюдента по формуле
 (1)
(1)
где J1, J2 - сравниваемые средние
арифметические значения интенсивности флуоресценции среды экспонирования в
опыте и контроле, рассчитывают по формулам
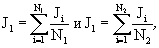 (2)
(2)
где N1, N2 - число
повторов в опыте и контроле соответственно, a D1, D2 - значения дисперсии
показателей интенсивности флуоресценции среды экспонирования в опыте и
контроле, рассчитывают по формулам
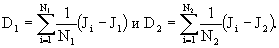 (3)
(3)
Полученное значение критерия сравнивают со
стандартным значением критерия Стьюдента приведенным в таблице 1 при
уровне значимости Р = 0,05.
Таблица 1 - Значения критериев Стьюдента t
|
Число степеней Свободы
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Критерий Стьюдента t
|
12,71
|
4,3
|
3,18
|
2,78
|
2,57
|
2,45
|
2,37
|
2,31
|
2,26
|
2,23
|
Вычисленное по формуле (1) эмпирическое значение критерия
сравнивают с табличным, определенным для соответствующей степени свободы К, за
которую принимают сумму объемов сравниваемых выборок, уменьшенную на две
единицы
K = N1 + N2
- 2. (4)
Если
вычисленное значение критерия больше табличного, (определяемого для уровня
значимости Р = 0,05), то различие в интенсивности флуоресценции среды
экспонирования в опыте и контроле, а, следовательно, и различие в
фильтрационной активности статистически достоверны. Следовательно, имеет место
влияние тестируемой воды на тест-объекты и данная проба должна быть исследована
количественными методами химического анализа. Если различия в фильтрационной
активности опытных и контрольных тест-объектов не выявлено ни для
фильтрованной, ни для интактной частей пробы, дальнейший химический анализ на
выявление особо опасных уровней загрязнения воды не производят.
Монокультуру
инфузорий Paramecium caudatum выращивают в стеклянных емкостях с отстоянной
дехлорированной водопроводной водой, в которую предварительно вносят в качестве
корма суспензию хлебопекарских дрожжей. Непосредственно перед кормлением дрожжи
распускают в теплой воде. Полученную суспензию добавляют в культуральную среду
с таким расчетом, чтобы итоговая плотность суспензии дрожжей составляла
приблизительно 5 миллионов дрожжевых клеток в 1 см суспензии. При этом
плотность суспензии можно контролировать в относительных единицах по показателю
мутности. Парамеций инкубируют при температуре приблизительно 20 °С, что близко
к их физиологическому оптимуму. Во избежание массового развития водорослей
культиваторы желательно устанавливать в затемненных условиях, избегая прямого
попадания света. Ежедневно один раз в сутки культуру подкармливают, добавляя
несколько капель свежей суспензии дрожжей в культиватор. В день постановки
опыта подкормку не вносят. Монокультуру культивируют в одном цельностеклянном
сосуде в течение 2 - 3 недель. Затем необходимо производить пересев в емкости
со свежей отстоянной водой.
[1]
Правила охраны поверхностных вод (типовые положения). - М.:
Госкомприрода СССР, 1991 г.
[2]
Трунов Н.М., Чмутенко Л.О., Ржевский В.Р., Мирошниченко Е.В.
Люминесцентно-микроскопический метод определения интенсивности питания
гидробионтов и его применение в биотестировании и биоиндикации качества вод //
Биоиндикация и биотестирование природных вод. - Ростов н/Д, 1986. - 142 с.
[3] Никаноров
А.М., Бражникова Л.В., Трунов Н.М., Дегтярев А.Ф., Шакунова Н.Н. Система
биологических тестов токсичности на Paramecium Caudatum
// Биоиндикация и биотестирование природных вод. - Ростов н/Д, 1986. - 120 с.
[4]
Никаноров А.М., Трунов Н.М. Внутриводоемные процессы и контроль качества
поверхностных вод. Под ред. Бедрицкого А.И. - С-Пб.: Гидрометеоиздат, 1999 г. -
155 с.
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)


