УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации,
Первый заместитель Министра здравоохранения Российской Федерации Г. Г. Онищенко 24 октября 2003 г. Дата введения: 1 декабря 2003 г. |
4.2. МЕТОДЫКОНТРОЛЯ.
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Метод микробиологического измеренияконцентрации
клеток Candida tropicalis Y-456 - продуцента ксилита
в атмосферном воздухе населенных мест
Методические указания
МУК 4.2.1773-03
Настоящие методические указания устанавливают методикупроведения микробиологического количественного анализа концентрации клетокштамма Candida tropicalis Y-456 -продуцента ксилита в атмосферном воздухе населенных мест в диапазонеконцентраций от 10 до 3 000 клеток в 1 м3 воздуха.
Методические указания разработаны в соответствии стребованиями ГОСТ17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методамопределения загрязняющих веществ» и Р 8.563-96 «Методики выполненияизмерений».
Методические указания предназначены для применения влабораториях предприятий, организаций и учреждений, аккредитованных вустановленном порядке на право проведения микробиологических исследований.
Методические указания одобрены и рекомендованы секцией«Гигиенические аспекты биотехнологии и микробного загрязнения окружающей среды»Проблемной комиссии «Научные основы гигиены окружающей среды».
На сусло-агаре на 2-3 сутки штамм образует круглыекремоватые колонии с ровным краем, средний диаметр изолированных колонийсоставляет 0,3 см, а максимальный - 0,8 см. В центре колоний образуется небольшоевозвышение - «бугорок», на среде появляется маленькое желто-оранжевоеокрашивание. Консистенция колоний мягкая, неплотная, вязкая. Поверхностьгладкая, слегка матовая.
Морфологически штамм представлен полиморфнымиклетками: округлые, овальные, большей частью одиночные 2-4 мкм, иногда цепочкиили конгломераты из вытянутых клеток 10-12 мкм. Наблюдается обилие бластоспор.
При выращивании на кукурузном агаре по Дальмау вчашках Петри обильно образуются псевдогифы с многократными разветвлениями ибластоконидиями, расположенными одиночно или цепочками вдоль гиф (8).
Систематическое положение микроорганизма
| Класс | Fungi imperfecti |
| Порядок | Blastomycetales |
| Род | Candida |
| Вид | tropicalis |
| Штамм | Y-456 |
Штамм получен из ЦМПМ ВНИИгенетика как продуцентэтанола и селектирован по признаку формирования крупных колоний на средах сксилозой. Штамм является продуцентом ксилита. Продуктивность на средах с 5 %содержанием ксилозы: максимальная -80 % ксилита, средняя - 78,8-76,2 % (39,5г/л) ксилита.
Штамм-продуцент растет на жидких и агаризованныхсредах. Оптимальная температура роста 35-37 °С, рН среды - 5,0-6,0. Дляразмножения используется сусло-агар 5-6°Б, среда ДАП - глюкоза (ксилоза) - 20г, дрожжевой экстракт - 2,0 г, пептон - 2 г, агар-агар -20 г, вода - 1 л, рНсреды - 5,0-6,0.
Предельно допустимая концентрация (ПДК) в атмосферномвоздухе населенных мест - 30 кл/м3, пометка А.
Методика обеспечивает выполнения измерений количестваклеток дрожжевого гриба в атмосферном воздухе населенных мест в диапазонеконцентраций от 10 до 3 000 клеток в 1 м3 воздуха при доверительнойвероятности 0,95.
Метод основан на аспирации из воздуха клетокдрожжеподобного гриба на поверхность среды сусло-агар и подсчета выросшихколоний по типичным культурально-морфологическим признакам на 2 сутки развития.В качестве дополнительного контроля предлагается отбор пробы на чашку Петри сселективной средой для дифференцирования С. tropicalis от других дрожжеподобныхгрибов, обладающих способностью к образованию ростковых трубок (9,10).
При выполнении измерений применяют следующие средстваизмерений, вспомогательные устройства и материалы.
| 5.1. Средства измерений, вспомогательные устройства, материалы
| Прибор для бактериологического анализа воздуха, модель 818(щелевой прибор Кротова) | ТУ 64-12791-77 |
| Термостаты электрические суховоздушные или водяные | |
| Автоклав электрический | ГОСТ 9586-75 |
| Бокс, оборудованный бактерицидными лампами | |
| Холодильник бытовой | |
| Весы лабораторные, аналитические типа ВЛА-200 | |
| Микроскоп биологический с иммерсионной системой типа «Биолам» Л-211 | |
| Лупа с увеличением ×10 | ГОСТ 25706-83 |
| Чашки Петри бактериологические плоскодонные, стеклянные, диаметром 100мм | |
| Пробирки биологические, вместимостью20 и 35 мл Пипетки мерные на 1,5 и 10 мл Пипетки мерные на 1,5 и 10 мл | ГОСТ 10515-75 ГОСТ 10515-75 ГОСТ 1770-74 |
| Колбы конические, вместимостью 250 и 500 мл | ГОСТ 1770-74 |
| Секундомер | ГОСТ 9586-75 |
| Барометр | ГОСТ 24696-79 |
| Марля медицинская | ГОСТ 9412-77 |
| Вата медицинская гигроскопическая | ГОСТ 25556- 81 |
|
| 5.2. Реактивы, растворы
| Среда сусло-агар: солодовое сусло (значение Баллинга от 5 до 6°) - 98 %, агар-агар - 2 %, рН среды 5,0-6,0, режим стерилизации: Р - 0,8 кгс/см2, 40 мин. | |
| Спирт этиловый ректификат | ГОСТ 5962-67 |
| Сыворотка или плазма крови человека ( вместо них можно использовать среду 199). тибиотик биомицин (хлортетрациклина гидрохлорид). | |
|
При выполнении измерений концентрации клеток штаммапродуцента в воздухе рабочей зоны соблюдают следующие требования:
6.1. Правила техники безопасности при работе с химическимиреактивами по
ГОСТ12.1.005-88..
6.2. Электробезопасность при работе сэлектроустановками по
ГОСТ12.1.005-88.и инструкции по эксплуатации прибора.
6.3. «Инструкции по устройству, требованиямбезопасности и личной гигиены при работе в микробиологических лабораторияхпредприятий микробиологической промышленности» (1977).
6.4. Все виды работ с реактивами проводят только ввытяжном шкафу при работающей вентиляции, работа с биологическим материаломосуществляется в боксе, оборудованном бактерицидными лампами.
7. Требования к квалификации операторов
К выполнению измерений и обработке их результатовдопускают лиц с высшим или средним специальным образованием, прошедшихсоответствующую подготовку и имеющих навыки работы в области микробиологическихисследований.
8. Условия измерений
Процессы приготовления растворов и подготовки проб канализу проводят в нормальных условиях при температуре воздуха (20 ± 5 °С),атмосферном давлении 30-800 мм рт. ст. и влажности воздуха не более 80 %.
9. Проведение измерения
9.1. Условия отбора проб воздуха
Для определения концентрации клеток продуцента воздухаспирируют при помощи аппарата Кротова со скоростью 10 л/мин на поверхностьсреды сусло-агар. Время аспирации воздуха (5- 20 мин) зависит от предполагаемойконцентрации клеток штамма-продуцента.
Аппарат Кротова перед каждым отбором пробы воздухатщательно протирают спиртом. Особенно тщательно обрабатывают поверхностьподвижного диска и внутреннюю стенку прибора, наружную и внутреннюю стенкукрышки. На подвижной диск устанавливают подготовленную чашку Петри со средой,одновременно снимая с нее крышку. Прибор закрывают. Соприкосновение крышкиприбора со средой недопустимо. После отбора пробы воздуха и остановки диска,прибор открывают, быстро снимают чашку Петри и закрывают крышкой от даннойчашки. На дне чашки Петри стеклографом отмечают точку контроля, время аспирациии дату отбора пробы.
9.2. Выполнение анализа
Метод предполагает учет количества типичных колоний,выросших на 2 сутки после посева проб воздуха по культурально-морфологическимпризнакам. Метод позволяет учитывать на чашке до 200 колоний продуцента.
Агаризованную среду сусло-агар расплавляют, остужаютдо 50-60 °С, тщательно перемешивают и разливают по 10 мл в стеклянные чашкиПетри на горизонтальной поверхности.
Чашки с застывшей средой помещают в термостат на суткипри температуре 37 °С, после чего проросшие чашки бракуют, стерильные чашкииспользуют для контроля воздуха.
После отбора проб воздуха, чашки Петри помещают в термостат при температуре 37 °С. На 2-есутки производят подсчет выросших типичных колоний продуцента. Принеобходимости культуру подвергают микроскопированию.
Для постановки дополнительного контроля в средудобавляют сыворотку или плазму крови человека (можно также заменить средой 199)из расчета 0,5 мл сыворотки на 5 мл среды. После отбора проб инкубируют при 37°С в течение 3 часов. При микроскопировании некоторые дрожжеподобные грибы (С.albicans) в отличие от С. tropicalis на селективной среде образуют ростковыетрубки диаметром 3-4 мкм и длиной до 20 мкм (они сходны с мицелием, но не даютсужения в месте прикрепления к дрожжевой клетке).
10. Вычисление результатов измерения
Расчет концентрации клеток продуцента в пересчете на 1м' воздуха производят по формуле:
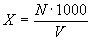 кл/м3 ,где
кл/м3 ,где
Х- концентрация клеток продуцента в воздухе,
N - количество колоний продуцента, выросших на чашке,
1 000 - коэффициент пересчета на 1 м3воздуха,
V - объем воздуха, л (произведение скорости на времяаспирации).
11. Оформление результатов измерений
Результаты измерений оформляют протоколом по форме.
Протокол №
количественного микробиологического анализа
штамма-продуцента Candida tropicalisY-456
в атмосферном воздухе населенных мест
1.Дата проведения анализа______________________
2. Место отбора пробы___________________________
3.Название лаборатории__________________________
4.Юридический адрес организации__________________
Результаты микробиологического анализа
| Шифр или № пробы | Определяемый микроорганизм | Концентрация, кл/м3 |
| | | |
Ответственный исполнитель
Научный руководитель
Список литературы
1. Руководство по контролю загрязнения атмосферы: РД52.04.186-96. М., 1991. 693 с.
2. ГОСТ 8.563-96. ГСИ «Методикивыполнения измерений».
3. Положение об организации работы по техникебезопасности микробиологической промышленности. М., 1980. 27 с.
4. Инструкции по устройству, требованиям безопасностии личной гигиены при работе в микробиологических лабораториях предприятиймикробиологической промышленности. М., 1977.7 с.
5. ГОСТ17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методамопределения загрязняющих веществ». М.: Изд-во стандартов, 1981. 3 с.
6. Влодавец В. В., Немыря В. И.Санитарно-микологический контроль объектов окружающей среды на предприятияхмикробиологической промышленности// Гиг. и сан., 1977. № 1. 25-28 с.
7. Бабьева И. П., Зенова Г. М. Биология почв. М.: МГУ.122 с.
8. Саттон Д., Фотергилл А., Ринальди М. Определительпатогенных и условно патогенных грибов. М.: Мир, 2001. 110 с.
9. Кашкин П. Н., Лисин В. В. Практическое руководствопо медицинской микологии. М.: Медицина, 1983. 153 с.
10. Kwon-Chung К. J., Bennett J. E. Medical mycology. Philadelphia:Lea & Febiger, 1992. P. 61-62.
СОДЕРЖАНИЕ
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)

