УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации,
Первый заместитель Министра здравоохранения Российской Федерации Г. Г. Онищенко 24 октября 2003 г. Дата введения: 1 декабря 2003 г. |
4.2. МЕТОДЫ КОНТРОЛЯ.
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Метод микробиологического измерения концентрации
клеток Aspergillus terreus 44-62 - продуцента ловастатина
в атмосферном воздухе населенных мест
Методические указания
МУК 4.2.1768-03.
Методические указания. - М.:Федеральный центр Госсанэпиднадзора Минздрава России,2004. .
1. Разработаны Российским государственным медицинским университетом (к. б. н. Н. И. Шейной).
2. Утверждены Первым заместителем министра здравоохранения РоссийскойФедерации - Главный государственным санитарным врачом Российской Федерации 24 октября 2003 г.
3. Введены в действие с I декабря 2003 г.
.Введены впервые.
Настоящие методические указания устанавливают методикупроведения микробиологического количественного анализа концентрации клетокштамма Aspergillus terreus 44-62 -продуцента ловастатина в атмосферном воздухе населенных мест в диапазонеконцентраций от 10 до 3 000 клеток в 1 м3 воздуха.
Методические указания разработаны в соответствии стребованиями ГОСТ17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методамопределения загрязняющих веществ» и Р 8.563-96 «Методики выполненияизмерений».
Методические указания предназначены для применения влабораториях предприятий, организаций и учреждений, аккредитованных вустановленном порядке на право проведения микробиологических исследований.
Методические указания одобрены и рекомендованы секцией«Гигиенические аспекты биотехнологии и микробного загрязнения окружающей среды»Проблемной комиссии «Научные основы гигиены окружающей среды».
Штамм Aspergillusterreus 44-62 является продуцентом ловастатина. Штамм-продуцент растет нажидких и агаризованных средах. Рост на питательной среде и ферментация могутпроисходить при температуре 20-37 °С. Оптимальная температура роста 27- 30 °С,оптимальное значение рН среды - 5,0-6,0, культивирование 12 суток.
Строгий аэроб. Утилизирует глюкозу, фруктозу, мальтозуи глицерин. Хорошо растет на многих органических субстратах: овсяная, рисовая икукурузная мука. В качестве источников азота благоприятно использованиепептона, дрожжевого экстракта, гидролизата казеина. Среди неорганических солейпредпочтительно использование хлорида натрия, сульфата магния и фосфата калия.Для размножения можно использовать сусло-агар 5-6 °Б.
Систематическое положениемикроорганизма
| Класс | Fungi imperfecti |
| Порядок | Hyphomycetales |
| Семейство | Mucedinaceae |
| Секция | Monoverticillata |
| Род | Aspergillus |
| Вид | terreus |
| Штамм | 44-62 |
Уже на 4-5 дни развития гриб появляется в виде характернойкремоватой округлой маленькой колонии с оранжевым пятном в центре. Поверхностьколонии бахатисто-шероховатая. Однако своего терминального развития микромицетдостигает к 11-12 дню, когда наиболее ярко выражены егокультурально-морфологические свойства.
12-суточная культура на агаризованной питательнойсреде представляет собой округлые неправильной формы колонии с характернойнерегулярно изрезанной поверхностью, напоминающей вулканический профиль. Вцентре колонии, как правило, имеется кратер. Максимальный диаметр колоний3,5-4,0 см.
Окраска колоний от оранжево-коричневого у основания дожелто-коричневого на вершине. Мицелий плотный, компактный без воздушногопушистого слоя. Гифы короткие, сильно разветвленные, состоящие из расширенныхклеток нерегулярной формы. Боковые ветви короткие, пор немного. Типичныхконидиеносцев нет. Субстратный мицелий прорастает глубоко в питательную среду,образуя воздушные полости на дне чашки.
Предельно допустимая концентрация (ПДК) в атмосферномвоздухе населенных мест - 30 кл/м3, пометка А.
Методика обеспечивает выполнения измерений количестваклеток плесневого гриба в атмосферном воздухе населенных мест в диапазонеконцентраций от 10 до 3000 клеток в 1 м3 воздуха при доверительной вероятности0,95.
Метод основан на аспирации из воздуха клетокплесневого гриба на поверхность среды сусло-агар и подсчета выросших колоний потипичным культурально-морфологическим признакам на А - 5 сутки развития приповышенной температуре.
При выполнении измерений применяют следующие средстваизмерений, вспомогательные устройства и материалы.
| 5.1. Средства измерений, вспомогательные устройства, материалы
| Прибор для бактериологического анализа воздуха, модель 818(щелевой прибор Кротова) | ТУ 64-12791-77 |
| Термостаты электрические суховоздушные или водяные | |
| Автоклав электрический | ГОСТ 9586-75 |
| Бокс, оборудованный бактерицидными лампами | |
| Холодильник бытовой | |
| Весы лабораторные, аналитические типа ВЛА-200 | |
| Микроскоп биологический с иммерсионной системой типа «Биолам» Л-211 | |
| Лупа с увеличением ×10 | ГОСТ 25706-83 |
| Чашки Петри бактериологические плоскодонные, стеклянные, диаметром 100мм | |
| Пробирки биологические, вместимостью20 и 35 мл Пипетки мерные на 1,5 и 10 мл Пипетки мерные на 1,5 и 10 мл | ГОСТ 10515-75 ГОСТ 10515-75 ГОСТ 1770-74 |
| Колбы конические, вместимостью 250 и 500 мл | ГОСТ 1770-74 |
| Секундомер | ГОСТ 9586-75 |
| Барометр | ГОСТ 24696-79 |
| Марля медицинская | ГОСТ 9412-77 |
| Вата медицинская гигроскопическая | ГОСТ 25556- 81 |
|
| 5.2. Реактивы, растворы
| Среда сусло-агар: солодовое сусло(значение Баллинга от 5 до 6°) - 98 %, агар-агар - 2 %, рН среды 5,0 - 6,0, режим стерилизации: Р - 0,8 кгс/см2, 40 мин | |
| Спирт этиловый ректификат | ГОСТ 5962-67 |
| Молочная кислота(синоним-альфа-оксипропионовая кислота, для подавления посторонней бактериальной флоры) | ГОСТ 490-79 |
|
При выполнении измерений концентрации клеток штамма-продуцентав атмосферном воздухе рабочей зоны соблюдают следующие требования.
6.1. Правила техники безопасности при работе схимическими реактивами по ГОСТ12.1.005-88.
6.2. Электробезопасность при работе сэлектроустановками по ГОСТ12.1.019-79 и инструкции по эксплуатации прибора.
6.3. «Инструкции по устройству, требованиямбезопасности и личной гигиены при работе в микробиологических лабораторияхпредприятий микробиологической промышленности» (1977).
6.4. Все виды работ с реактивами проводят только ввытяжном шкафу при работающей вентиляции, работа с биологическим материаломосуществляется в боксе, оборудованном бактерицидными лампами.
К выполнению измерений и обработке их результатовдопускают лиц с высшим или средним специальным образованием, прошедших соответствующуюподготовку и имеющих навыки работы в области микробиологических исследований.
Процессы приготовления растворов и подготовки проб канализу проводят в нормальных условиях при температуре воздуха (20 ± 5 °С), атмосферномдавлении 630-800 мм рт. ст. и влажности воздуха не более 80 %.
9.1. Условия отбора проб воздуха
Для определения концентрации клеток плесневого грибавоздух аспирируют при помощи аппарата Кротова со скоростью 15 л/мин на поверхностьсреды сусло-агар. Время аспирации воздуха (5- 30 мин) зависит от предполагаемойконцентрации клеток штамма-продуцента.
Аппарат Кротова перед каждым отбором пробы воздухатщательно протирают спиртом. Особенно тщательно обрабатывают поверхность подвижногодиска и внутреннюю стенку прибора; наружную и внутреннюю стенку крышки. Наподвижной диск устанавливают подготовленную чашку Петри со средой, одновременноснимая с нее крышку. Прибор закрывают. Соприкосновение крышки прибора со средойнедопустимо. После отбора пробы воздуха и остановки диска, прибор открывают,быстро снимают чашку Петри и закрывают крышкой от данной чашки. На дне чашкиПетри стеклографом отмечают точку контроля, время аспирации и дату отборапробы.
9.2. Выполнение анализа
Метод предполагает учет количества типичных колоний,выросших на 3 сутки после посева проб воздуха, по культурально-морфологическимпризнакам и яркой оранжево-желтой пигментации среды. Прямой метод позволяетучитывать на чашке до 100 колоний продуцента.
Агаризованную среду сусло-агар расплавляют, остужаютдо 50-60 °С, добавляют молочную кислоту из расчета 2 мл на 0,5 л среды (дляподавления посторонней бактериальной микрофлоры), тщательно перемешивают иразливают по 10 мл в стеклянные чашки Петри на горизонтальной поверхности.
Чашки с застывшей средой помещают в термостат на суткипри температуре 37 °С, после чего проросшие чашки бракуют, стерильные чашкииспользуют для контроля воздуха.
После отбора проб воздуха чашки Петри помещают втермостат при температуре 38-42 °С (повышенная температура, способствующаяболее быстрому росту колоний и плодоношений рода As-pergillus). Через 3-5 суток производят подсчет выросших типичныхколоний продуцента. При необходимости культуру подвергают микроскопированию.
Расчет концентрации клеток продуцента в пересчете на 1м' воздуха производят по формуле:
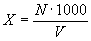 кл/м3 ,где
кл/м3 ,где
Х- концентрация клеток продуцента в воздухе,
N - количество колоний продуцента, выросших на чашке,
1 000 - коэффициент пересчета на 1 м3воздуха,
V - объем воздуха, л (произведение скорости на времяаспирации).
Результаты измерений оформляют протоколом по форме.
Протокол №
количественного микробиологического анализа штамма-продуцента
Aspergttlus terreus 44-62 в атмосферном воздухе
населенных мест
1. Дата проведения анализа______________
2. Место отбора пробы__________________
3.Название лаборатории_________________
4.Юридический адрес организации_______
Результаты микробиологического анализа
| Шифр или № пробы | Определяемый микроорганизм | Концентрация, кл/м3 |
| | | |
Ответственный исполнитель
Научный руководитель
1. Руководство по контролю загрязнения атмосферы: РД52.04.186-96. М. 1991.693с.
2. ГОСТ 8.563-96. ГСИ «Методикивыполнения измерений».
3. Положение об организации работы по техникебезопасности микробиологической промышленности. М.,1980. 27 с.
4. Инструкции по устройству, требованиям безопасностии личной гигиены при работе в микробиологических лабораториях предприятиймикробиологической промышленности. М., 1977. 7 с.
5. ГОСТ17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методамопределения загрязняющих веществ».
6. Влодавец В. В. К определению плесневых грибов рода Asper-gillusв воздухе лечебных учреждений// Гиг. и сан., 1988. № 8. С. 93- 95.
7. Бабьева И. П., Зенова Г. М. Биология почв. М.: МГУ.122с.
содержание
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)

