ГОСУДАРСТВЕННАЯ СИСТЕМА САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО
НОРМИРОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
4. МЕТОДЫ
КОНТРОЛЯ
МИКРОБИОЛОГИЧЕСКИЙ
МОНИТОРИНГ
ПРОИЗВОДСТВЕННОЙ СРЕДЫ
МЕТОДИЧЕСКИЕ
УКАЗАНИЯ
МУК 4.2.734-99
Минздрав России
Москва 1999
1.
Разработаны: Государственным научно-исследовательским институтом стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасовича (Н. В. Медуницын, Т. А. Бектимиров, Т. Е. Елизарова); Проектно-строительным предприятием «Чистый воздух» (М. Е. Барабанова, А. П. Коротовских, В. В. Михнович, А. В. Тютюнников).
2. Рекомендованы
Комиссией по госсанэпиднормированию при Минздраве России.
3. Утверждены
и введены в действие Главным государственным санитарным врачом Российской
Федерации - Первым заместителем министра Здравоохранения
Российской Федерации.
4. Введены
впервые.
СОДЕРЖАНИЕ
УТВЕРЖДАЮ
Главный государственный
санитарный
врач Российской
Федерации
Г. Г. Онищенко
10 марта 1999 г.
МУК 4.2.734-99
Дата введения -
10 мая 1999 г.
4. МЕТОДЫ
КОНТРОЛЯ
Микробиологический
мониторинг
производственной
среды
Методические
указания
МУК 4.2.734-99
Данный документ
предназначен в основном для производителей медицинских иммунобиологических
препаратов (МИБП) и может служить в качестве руководства по методам общего
микробиологического контроля в чистых помещениях, который включает в себя
контроль воздуха рабочих зон, контроль поверхностей помещений и оборудования,
контроль рук и одежды персонала.
Методические
указания «Микробиологический мониторинг производственной среды» являются
приложением к санитарным правилам СП 3.3.2.015 «Производство и контроль
медицинских иммунобиологических препаратов для обеспечения их качества. Good Manufacturing Practice»,
утвержденным постановлением Госкомсанэпиднадзора России № 8 от 12.08.94 г., а также продолжением соответствующих разделов Методических
рекомендаций МУ 44-116 «Асептическое
производство медицинских иммунобиологических препаратов», утвержденных МЗ
России 19.05.97 г.
Микробиологический
контроль воды, сжатого воздуха и других технологических газов,
контроль механических частиц в данных методических указаниях не
рассматриваются.
В данных методических
указаниях рассматриваются ключевые факторы, которые необходимо учитывать при
разработке и проведении программ микробиологического контроля производственной
среды, составлении планов отбора проб, выборе методов и приборов для проведения
исследований, установлении уровней тревоги и действия.
Приводимые в
данном документе цифровые данные, методы отбора проб, приборы являются
рекомендуемыми. Целесообразно их применение с учетом конкретных
производственных условий и технологий.
Для достижения
соответствующего микробиологического статуса производственной среды (см. табл.
1.3 приложения 1 к Методическим рекомендациям МУ 44-116
«Рекомендуемые максимальные пределы контаминации окружающей среды в рабочих
условиях») могут использоваться методы, эквивалентные тем, которые вошли в
данные методические указания.
В данных
методических указаниях используются следующие определения:
Асептическое
наполнение - часть асептического процесса, в котором стерильный продукт
разливается и упаковывается с использованием стерильных емкостей и крышек в
критических производственных зонах.
Асептическое
производство - включает все операции приготовления МИБП,
в том числе и асептическое наполнение емкостей продуктом в контролируемых
условиях среды, где воздухоподача, материалы, оборудование и персонал
соответствующим образом контролируются на приемлемые уровни микробной
контаминации и контаминации механическими частицами.
Асептические
производственные зоны (АПЗ) - контролируемая среда, состоящая из
нескольких зон, в которых воздухоподача, материалы, оборудование
и персонал контролируется на приемлемые уровни
микробной контаминации и контаминации механическими частицами.
Аэрозольный
пробоотборник - прибор, используемый для отбора заданных объемов воздуха за
определенный временной промежуток, в целях определения количественного
содержания микроорганизмов или механических частиц.
Биологическая
нагрузка - общее количество живых микроорганизмов в продукте перед процессом
стерилизации.
Валидация
(аттестация) - получение документированного подтверждения того, что
конкретный производственный процесс обеспечит с высокой степенью надежности
получение продукта, отвечающего заранее установленным спецификациям и
показателям качества.
Контролируемая
среда - среда производственных помещений, в которой содержание
механических и живых частиц поддерживается на определенных уровнях.
Корректирующие
действия - действия, которые необходимо предпринимать, в случае, если
результаты контроля окружающей среды выявляют превышение уровня действия.
Колониеобразующая единица (КОЕ) - число живых
микроорганизмов, определяемое по проросшим единичным колониям на плотных
питательных средах, содержащееся в определенных объемах исследуемых проб.
Критические
производственные зоны - локальные зоны, асептического производства, в которых совершаются асептические манипуляции с
продуктом, асептический монтаж оборудования, операции наполнения и укупорки,
где продукт подвергается наибольшему риску контаминации. Данные зоны, как
правило, располагаются в классах чистоты А, В (100), в соответствии с МУ 44-116.
Критические
поверхности - поверхности, находящиеся в зоне выполнения асептических операций,
непосредственно контактирующие со стерильным материалом (емкостями,
инструментарием и пр.).
Окружающая флора
- микроорганизмы, выделенные из производственной среды совокупностью
микробиологических методов исследования.
План отбора проб
- документ, описывающий методику отбора проб в контролируемой среде,
устанавливающий точки отбора проб, частоту и количество регулярно проводимых
исследований, методы анализа данных и интерпретацию полученных результатов.
Программа
мониторинга окружающей среды - документально определенная программа,
которая описывает правила текущего мониторинга производственной среды по всем
контролируемым параметрам - влажность, температура,
скорость воздушных потоков, уровень перепада давления между помещениями,
уровень контаминации бактериальными и
механическими частицами и включает в себя план мероприятий при превышении
результатов контроля уровня действия.
Стерилизация - валидируемый процесс, используемый для освобождения продукта от живых
микроорганизмов.
Стерильный - заявленный как
свободный от живых микроорганизмов.
Терминальная
стерилизация - процесс, при котором продукт стерилизуется в своей конечной
емкости.
Точка отбора
пробы - отраженное в документах место в контролируемой зоне, где
производится отбор пробы для дальнейших микробиологических
исследований. Точка выбирается, исходя из потенциального влияния на
стерильность продукта.
Уровень действия
- установленный критический уровень содержания микробов или
механических частиц, требующий немедленного вмешательства и корректирующих
действий, если он превышен.
Уровень тревоги
- установленный докритический уровень содержания микробов или
механических частиц, дающий раннее предупреждение о возможном
отклонении от нормальных рабочих условий производства, не требующий немедленного вмешательства и исправляющих
действий, но который является поводом для проведения дополнительных контролей.
Чистая зона - заданное пространство,
где концентрация живых и механических частиц в воздушной среде поддерживается в
установленных пределах в соответствии с классом чистоты.
Чистая комната -
комната,
где концентрация живых и механических частиц в воздушной среде поддерживается
на заданном уровне, определяемым классом чистоты.
Основной целью
программы оценки микробиологического состояния производственной среды является
постоянная гарантия стабильности асептических условий производства МИБП,
выявление начальных отклонений и выработка корректирующих действий до
возникновения ситуаций, приводящих к появлению нестерильной продукции.
Метод контроля
стерильности готового препарата (ГФ XI, вып.
2, с. 187) основан на выборочном исследовании
части серии, и не дает полной гарантии стерильности каждой емкости в серии. Поэтому необходимо проводить промежуточные тесты на
стерильность препарата в процессе производства, а также качественный и
количественный контроль асептических условий (класса чистоты рабочих зон).
4.1.
Программа микробиологического мониторинга окружающей среды в АПЗ должна
охватывать:
- оценку
бактериальной контаминации воздуха (КОЕ/м3);
- оценку
бактериальной контаминации критических поверхностей, рук и одежды персонала,
работающих в АПЗ;
- оценку
эффективности очистки и дезинфекции помещений и оборудования;
- тестирование
активности дезинфектантов;
- оценку
эффективности работы стерилизующих воздушных фильтров;
- оценку
качества стерилизации.
4.2. Текущий
контроль в принципе не может и не должен выявить или подсчитать все микроорганизмы,
присутствующие в контролируемой среде. Он может только показать, что все
ключевые системы, контролирующие состояние
производственной среды, работают в
соответствии с установленными требованиями и лимиты бактериальной нагрузки не
превышены.
4.3. Задачей
микробиологического контроля является получение репрезентативной
оценки бактериальной нагрузки производственной среды.
4.4. Стабильность
асептических условий производственной среды должна обеспечиваться:
-
соответствующим проектом производства;
- технологичным
оборудованием (легко моющимся и дезинфицирующимся);
- адекватной
системой воздухоподготовки (фильтрация, перепад давлений);
- системой
ведения документации (рабочие инструкции и регистрация результатов контроля);
- валидированными и сертифицированными процессами деконтаминации;
- надежным
контролем технологического процесса;
- практикой
качественного поддержания чистоты (уборка, дезинфекция);
- контролем
доступа персонала в АПЗ (соответствующая одежда, процедура
переодевания);
- эффективными
программами обучения персонала;
- гарантией
качества материалов и оборудования.
4.5. Перечисленные
поддерживающие функции должны обеспечиваться персоналом соответствующей
квалификации, обученным правилам работы в АПЗ.
4.6. Программа
микробиологического мониторинга производственной среды является документом,
который периодически пересматривается и совершенствуется (см. раздел 17
Методических рекомендаций МУ 44-116).
5.1.
Вне зависимости от выбора метода тестирования, подготовка, технологический
процесс, стерилизация, асептические процессы, контрольные тесты, очистка и
дезинфекция оборудования и помещений, качество оборудования и используемых
материалов должны полностью отвечать требованиям GMP.
5.2. При
контроле используются только откалиброванное оборудование и
приборы, прошедшие метрологическую аттестацию.
5.3. Любой
метод, выбранный для текущего контроля должен предварительно пройти валидацию.
5.4. При текущем
мониторинге предпочтительно использовать те же методы, что и при первичной
аттестации чистого помещения или зоны. Любые изменения методов контроля могут
повлиять на результаты.
5.5. Ростовые
свойства питательных сред, используемых для микробиологических исследований,
должны подтверждаться использованием соответствующих штаммов микроорганизмов.
5.6. В
письменных инструкциях, описывающих процедуру микробиологического мониторинга,
следует четко излагать шаг за шагом последовательность проведения исследований.
5.7. Полученные
результаты должны регистрироваться в утвержденных по форме протоколах
(журналах). В случаях превышения установленных верхних лимитов бактериальной
нагрузки в АПЗ, должны быть отражены все проведенные расследования и
мероприятия.
5.8. Персонал,
выполняющий программу микробиологического мониторинга должен быть компетентен в
соответствующих научных дисциплинах, адекватно обучен и иметь необходимые
полномочия.
5.9. Все
исследования обычно проводятся производственными отделениями. Однако Отдел
гарантии качества или Технологический отдел, должен проводить периодические,
независимые исследования, повторяющие программу микробиологического
мониторинга. Периодичность обследования и протоколы утверждаются руководством
предприятия.
5.10.
Установление соответствующего уровня тревоги и уровня действия, выбор
адекватных методов контроля, являются предметами, постоянно требующими
пересмотра. Все соответствующие решения должны приниматься уполномоченным
персоналом.
5.11.
Уровни тревоги и действия, частота контроля, число точек отбора проб обычно
являются более строгими параметрами при процессе асептического розлива, чем при
производстве терминально стерилизуемого продукта.
5.12.
Процедуры микробиологического мониторинга обычно включают следующие шаги:
- выделения
микроорганизмов из производственной среды (на агаровую поверхность, в
питательный бульон или жидкость, на мембрану фильтра);
- посев,
если требуется, на питательную среду и культивирование;
- учет
результатов;
- анализ
совокупности полученных при мониторинге данных.
5.13. Данные
мониторинга следует учитывать для совершенствования практики уборки и
дезинфекции.
5.14.
Основные факторы, которые необходимо учитывать при определении методологии
проведения тестов, приводятся в приложении.
6.1.
Расположение точек отбора проб из воздуха и с поверхностей является
индивидуальным для каждого производителя и устанавливается в процессе первичной
или повторной аттестации чистого помещения или чистой зоны.
6.2. При запуске в эксплуатацию нового чистого помещения или зоны
проводится изучение
ее функционирования.
Процесс валидации
(аттестации) включает в себя:
- определение
профилей воздушных потоков (карта пространственного распределения);
- определение
профилей механических частиц (карта пространственного распределения);
- определение
профилей микроорганизмов (карта контаминации).
6.3. Периодическая
валидация проводится каждые полгода.
6.4. Карта
микробной контаминации, полученная при аттестации чистого помещения, выявляет
точки наибольшего бактериального загрязнения. Эта карта служит основой для
составления плана отбора проб при текущем контроле, учитывая потенциальное
влияние на контаминацию продукта.
6.5. Зоны
непосредственного контакта воздуха и поверхностей с емкостями, содержащими
стерильный продукт, являются критическими и тщательно контролируемыми. При
операциях асептического наполнения к таким зонам относятся места подачи
стерильных емкостей и крышек и места наполнения.
6.6. Ключевыми точками для отбора проб при текущем мониторинге являются
следующие:
- зоны наиболее
высокой вероятности контаминации продукта;
- зоны
наибольшего риска скопления микроорганизмов при нормальном рабочем процессе
(накопление пыли на поверхностях с электростатическими свойствами,
более холодных поверхностях; дверные ручки и т.д.);
-
труднодоступные зоны для уборки и дезинфекции;
- точки смежных
зон А, В (100);
- потенциальные
источники контаминации;
- зоны
возмущения воздушного потока рельефом поверхности, смешение потоков.
6.7. В первую
очередь микробиологическому мониторингу должны подвергаться следующие элементы
производственной среды:
- воздух
помещений;
-
технологическое оборудование;
- инструментарий;
- рабочие поверхности;
- руки оператора
в перчатках;
- одежда
персонала;
- контейнеры, в
которых хранится продукт;
- вода;
- сжатый воздух,
инертные газы.
Реже, но
периодически контролируемыми являются также:
- стены, пол и
потолок помещения;
- двери;
- мебель и
транспортные тележки;
- контейнеры для
сбора отходов;
- инструменты и
приборы для тестирования.
6.8. Система
подготовки и распределения воды также может быть источником контаминации. Микробиологическое
качество воды является ключевым фактором для производства МИБП,
так как она используется для приготовления препаратов и для различных процессов
мойки и ополаскивания. В системе распределения воды следует выбрать контрольные
точки, при необходимости оборудовать порты для отбора проб.
6.9.
Ниже приводятся некоторые примеры точек отбора проб, которые могут считаться
наиболее существенными.
|
Система
|
Точка
отбора пробы
|
|
Воздух (линия розлива)
|
Около наполняемых емкостей
|
|
Воздух помещения
|
Точки входа и выхода вентиляционной системы,
зона манипуляций с продуктом
|
|
Вода
|
Кран водопользования или наполнительной емкости
|
|
Поверхность (помещение)
|
Рабочий стол
|
|
Поверхность (оборудование)
|
Поверхности, контактирующие с продуктом
|
|
Оператор линии розлива
|
Руки в перчатках
|
|
Сжатый воздух
|
Наиболее удаленная от компрессора точка
|
|
Ламинарный поток
|
Около объектов, создающих возмущение потока
|
6.10. Перечисленные
выше точки отбора проб выбираются каждым предприятием индивидуально,
с учетом конкретных производственных условий и зависят также от:
- планировочных
решений;
- конфигурации
линии розлива;
- данных валидации;
- архивных
данных о процессе;
- методологии тестирования,
и т.д.
6.11.
Число контрольных точек на одно помещение при текущем контроле:
- воздух - не
менее трех;
- поверхности -
не менее трех;
- руки - у
каждого оператора.
7.1. Частота
отбора проб зависит от установленного класса чистоты для данного помещения и от
вида обработки, которой подвергается продукт далее в процессе его производства.
7.2. Зоны класса
А (100) должны проверяться каждую рабочую смену, зоны класса В
(100) также могут проверяться каждую смену или ежедневно, в то время как
вспомогательные зоны могут проверяться с меньшей периодичностью, например: зоны
класса С (10000) - два раза в неделю, зоны класса D (100000) - еженедельно.
7.3. Для
сравнительного анализа состояний производственной среды, отбор проб должен
проводиться в одно и то же, фиксированное в плане время, т.е. приходиться на
равнозначную по интенсивности технологического процесса временную точку.
7.4.
Следующие временные точки для отбора проб являются обязательными:
|
Контроль
элементов среды
|
Время
|
|
Воздух
|
Во время работы
|
|
Поверхности
|
Перед работой
|
|
Руки оператора
|
Перед выполнением асептических манипуляций
|
Дополнительно,
могут проводиться исследования по окончании работы для оценки бактериальной нагрузки
за рабочую смену.
7.5.
Периодичность проведения микробиологического мониторинга может значительно
варьироваться в зависимости от:
- типа
производимого продукта;
- планировочных
и технологических решений;
- степени
вмешательства человека в процесс;
- использования
терминальной стерилизации;
- данных
предшествующего контроля и прочих факторов.
7.6.
Технологический процесс, включающий ручные операции, имеет повышенный риск контаминации
продукта, в этих случаях частоту проведения текущего контроля следует
увеличить.
7.7.
Ниже в таблице приводится рекомендуемая периодичность проверки контролируемой
среды.
|
Зоны отбора
проб
|
Периодичность
отбора проб
|
|
Асептически изготовляемые МИБП
|
|
Помещения или зоны А (100)
|
каждую смену
|
|
Окружающие зоны В (100) для зон класса А (100)
|
каждую смену или ежедневно
|
|
Вспомогательные зоны С (10000)
|
два раза в неделю
|
|
Зоны класса D (100000) или вспомогательные зоны
потенциального воздействия на продукт
|
еженедельно
|
|
Другие вспомогательные зоны, не имеющие потенциального
контакта с продуктом
|
один раз в две недели
|
|
Терминально стерилизуемые МИБП*
|
|
Зоны прямого контакта с продуктом
|
один раз в неделю
|
|
Зоны, не имеющие прямого воздействия на продукт
|
один раз в две недели
|
|
Стерильные МИБП для наружного
применения
|
|
** Зоны прямого контакта с продуктом
|
один раз в две недели
|
|
Зоны, не имеющие прямого воздействия на продукт
|
один раз в три недели
|
* если существуют требования к проверке
биологической нагрузки продукта;
** если в течение 12 месяцев не обнаруживается значительных отклонений в
результатах, полученных при проверке, периодичность можно уменьшить до одного
раза в три недели.
8.1.
Объем пробы воздуха должен быть достаточным как для обнаружения микроорганизмов
в заданном объеме воздуха, так и для роста дискретных и пригодных к подсчету
колоний на фильтрующей мембране или агаровой пластине.
8.2. Оптимальным
количеством КОЕ, выросших на мембране, считается менее 30 и на агаровых
пластинах (чашках Петри) - менее 300 колоний.
8.3. Для импакторов
и центрифужных пробоотборников одним из ограничивающих факторов является
высыхание поверхности агара при больших объемах проб, а также возможность
повреждения целостности агарового слоя
(растрескивание).
8.4. Объем пробы
воздуха должен устанавливаться опытным путем, с учетом характеристик
используемого пробоотборника и концентрации микроорганизмов в тестируемой зоне.
8.5. Для снятия
смывов с плоских поверхностей рекомендуемой является площадь размером 24-30
см2, а также стандартные места,
например, отпечатки пальцев на агаре, смыв
тампоном с предплечий рук на халатах у операторов.
9.1.
Выбор питательной среды для проведения микробиологического мониторинга является
одним из важных факторов. Питательная среда должна поддерживать рост широкого
спектра микроорганизмов, включая дрожжи и грибы.
9.2. Приемлемой
средой для контроля микробной загрязненности является среда № 1 (по ГФ изд. XI,
вып. 2, с. 200) для бактерий и среда № 2 (агар Сабуро) для дрожжей и грибов.
Посевы на среде № 1 инкубируются при температуре от 30 до 35 °С в течение 48 ч, на агаре Сабуро - от 20 до 25 °С в течение 72 ч.
9.3. Перед
исследованиями, разлитые в чашки Петри или на пластины, питательные среды
необходимо выдерживать в термостате при температуре от 30 до 35 °С
в течение 24 ч для подтверждения их стерильности. Проросшие чашки бракуют.
9.4. Ростовые
свойства питательных сред должны быть проверены соответствующими тест-штаммами
(для среды № 1 и среды № 2 по ГФ изд. XI,
вып. 2, с. 208 «Требования к ростовым свойствам питательных сред»).
9.5. При
контроле поверхностей, предварительно обработанных дезинфицирующими
растворами, которые могут попадать в питательную среду и ингибировать рост
микроорганизмов, для инактивации действия
химических агентов необходимо добавлять в питательные среды нейтрализаторы,
например, твин-80, лецитин или другие (см. ГФ
изд. XI,
вып. 2, с. 195 «Определение антимикробного действия лекарственного средства»).
10.1. Все
выявленные в процессе мониторинга окружающей среды микроорганизмы подлежат
обязательной макроскопической (форма, цвет, консистенция колоний) и
микроскопической идентификации окрашенных по Граму мазков. Результаты
исследований должны регистрироваться в документах, где указывают основные
морфологические признаки: отношение к окраске по Граму, наличие или отсутствие
спорообразования, форма микроорганизмов (кокки, палочки, овоиды
и т. д).
10.2. Кроме
указанных методов морфологической идентификации существуют также:
- биохимические
тест-системы;
-
идентификационные автоматизированные системы.
Производитель
может по своему усмотрению применять любые дополнительные современные методы
идентификации микроорганизмов, в т.ч. специальные дифференциальные среды для
выявления определенных групп микроорганизмов, или специальные методы, например,
метод двуслойного агара для определения анаэробной контаминации.
10.3. При
обнаружении споровых бактерий или грибов необходимо проводить
дополнительные меры дезинфекции помещений.
Идентификация
дает возможность предположить источник контаминации, основываясь на преимущественном
распространении микроорганизмов во внешней среде:
|
Микроорганизмы
|
Пример
|
Источник
|
|
Грамотрицательные
|
Pseudomonas
|
вода
|
|
Грамположительные кокки
|
Staphylococcus
|
люди
|
|
Грамположительные палочки
|
Propionibacterium
|
люди, пыль
|
|
Грамположительные палочки (споры)
|
Bacillus
|
пыль
|
|
Плесень, дрожжи
|
Aspergillus
|
пыль
|
10.4. Люди, участвующие в
производственном процессе, также являются источником контаминации. Ниже приведены
группы микроорганизмов, преимущественно встречающиеся в определенных участках
тела человека:
|
Участки
тела человека
|
Группы
микроорганизмов
|
|
Кожа
|
Corynebacterium
Staphylococcus, Bacillus
|
|
Нос
|
Micrococcus,
Corynebacterium Staphylococcus
|
|
Подмышечные впадины
|
Micrococcus,
Corynebacterium, Sarcina
|
|
Десны
|
Streptococcus,
Corynebacterium
|
В
фармацевтической промышленности на протяжении многих лет используются
установленные уровни содержания микроорганизмов, связанные с классом чистоты
помещений - А (100), В (100), С (10000) и D (100000), классификация, принятая ВОЗ и МСА (Серия технических
докладов Всемирной организации здравоохранения № 823).
Данные уровни считаются
достижимыми при использовании текущих технологий для контролируемых сред и приведены
в табл. 1.3, 4.1 (см. приложение 1, 4 Методических рекомендаций МУ 44-116 «Асептическое производство медицинских
иммунобиологических препаратов»).
Значения, приведенные
ниже в таблицах, дополняют и конкретизируют требования к классам чистоты, в
отношении поверхностей оборудования и помещений, одежды и рук персонала. Данные
по колониеобразующим единицам (КОЕ) относятся к неспорообразующим микроорганизмам. Присутствие спорообразующих бактерий, грибов и дрожжей недопустимо. При их выявлении
необходимо проведение дополнительных мер по дезинфекции и выявлению источников
контаминации.
Рекомендуемые
уровни чистоты поверхностей оборудования и помещения для контролируемых зон в колониеобразующих единицах (КОЕ)
|
Класс
|
КОЕ/контактная пластина*
|
|
В (100)
|
2
|
|
С (10000)
|
5
10 (на полу)
|
* площадь контактной пластины - от 24
до 30 см2.
При использовании
смывов с поверхностей необходимо, чтобы площадь снятия смыва была не менее 24 и
не более 30 см2.
Рекомендуемые уровни чистоты одежды и рук персонала, работающих в контролируемых зонах в колониеобразующих единицах (КОЕ)
|
Класс
|
КОЕ / контактная
пластина
|
|
Перчатки
|
Маска, предплечья,
бахилы (общее на 1 человека)
|
|
В (100)
|
3
|
5
|
|
С (10000)
|
10
|
20
|
Приведенные в
данной таблице уровни микробной контаминации одежды и рук персонала
устанавливаются на конец рабочей смены, при обычных рабочих
условиях. В начале рабочей смены одежда и перчатки должны быть стерильными.
Контроль стерильной одежды проводят 1 раз в две недели - непосредственно после
стерилизации одежды. Контролируют не менее 3 комплектов из каждой загрузки автоклава.
Анализ
результатов текущего контроля должен давать постоянную оценку соответствия
асептического процесса установленному уровню, т.е. удалось ли достичь
установленного класса чистоты для данного помещения.
В таблицах
4.1 и 4.2 (см. приложение 4 «Общий микробиологический мониторинг» Методических
рекомендаций МУ 44-116) приводятся уровни
действия для среды критических и некритических зон, а также мероприятия, рекомендуемые
в случае превышения данного уровня действия.
Программа
корректирующих мероприятий при превышении установленного уровня действия должна
быть разработана каждым производителем индивидуально, с учетом конкретных
производственных условий, документально оформлена. Протоколы заполняются
результатами предусмотренных дополнительных контролей, выводы проведенных
расследований подписываются ответственными лицами.
Уровни тревоги и
действия должны периодически пересматриваться в соответствии
с модернизацией процессов или потоков и технологий.
Программа
микробиологического мониторинга производственной среды должна быть составлена в
виде рабочего документа, включающего:
- инструкции,
описывающие порядок проведения контролей элементов
производственной среды;
- планы
помещений с указанием точек отбора проб;
- регулярность
отбора проб;
- временные
точки отбора проб в технологическом процессе;
- описание
приборов, инструкции по их эксплуатации;
- описание
используемых методов контроля;
- методы
идентификации микроорганизмов;
- уровни тревоги
и действия;
- программа
корректирующих мероприятий;
- формы
протоколов или журналов для регистрации результатов;
- фамилии
ответственных исполнителей и контролирующего лица.
Формы протоколов
контроля элементов производственной среды должны отражать
следующие параметры:
- дату и время
проведения теста;
- название
помещения (технологической стадии);
- метод
тестирования;
- температуру и
влажность помещения;
- дату последней
калибровки инструмента;
- уровень
активности в помещении;
- фамилию
оператора, проводящего отборы проб;
- объем
отобранной пробы воздуха или площадь, с которой взят смыв;
- количество
параллельных проб;
- температуру и
время инкубации;
- результаты
теста;
- дату получения
результатов теста;
-
сертификационные данные используемой питательной среды;
- идентификация
выявленных контаминантов (микроскопия окрашенных по Граму мазков);
- фамилию
оператора, проводящего оценку полученного результата;
- перечень
предпринятых, если необходимо, мероприятий или ссылку на протокол
корректирующих действий.
В данном
приложении рассматриваются преимущества и недостатки основных методов,
используемых в микробиологическом мониторинге для тестирования воздушной среды,
рабочих поверхностей, одежды и рук персонала.
Приведенный в
данных Методических рекомендациях список литературы может помочь производителю
в выборе приемлемых методов контроля.
1. Методы
тестирования воздушной среды
Микроорганизмы
потенциально всегда присутствуют в воздухе контролируемой рабочей зоны, т. к. HEPA-фильтры,
используемые для очистки, не имеют абсолютной 100 % эффективности, даже тогда, когда работают в
специфицированных условиях (класс чистоты А (100)
и В (100).
Основной целью микробиологического
контроля воздуха асептической зоны является определение уровня и спектра
микробной контаминации, чтобы оценить вероятность ее проникновения в
производимый продукт.
Для контроля
микробной контаминации воздуха применяют два метода -
пассивный (качественный) и активный (количественный).
К числу наиболее
популярных приборов, используемых в активных методах микробиологического
контроля воздуха, относятся импакторы и центрифужные
пробоотборники, где применяется плотная агаровая питательная среда.
Пассивный метод заключается в
экспозиции открытой плотной питательной среды в течение определенного периода
времени. Главным недостатком метода является выявление только больших быстрооседающих
частиц и неопределенность в объеме отобранной пробы. Фактически данный метод
является качественным и позволяет лишь определить спектр присутствующих
микроорганизмов.
1.1.
Активные методы и приборы для контроля микробной контаминации воздуха
Для выбора
приемлемого метода активного отбора проб следует учитывать следующие факторы:
- ожидаемая
концентрация КОЕ в воздушной среде;
- способность
метода работать в условиях низкой концентрации КОЕ;
- чувствительность
бактерий к процедуре пробоотбора;
- время и
продолжительность отбора пробы;
- свойства
прибора (эффективность, объемы проб);
- возможность
деконтаминации прибора.
Выбор прибора и
правильность его использования являются областью ответственности производителя.
Наиболее часто в
фармацевтической промышленности используются щелевые импакторы
и центрифужные пробоотборники типа RCS.
Учитывая
приемлемость по основным характеристикам и удобство использования,
рекомендуется применять аэрозольные пробоотборники типа «Флора-100»
или Biotest RCS (см. приложение Б
«Аэрозольные пробоотборники для контроля бактериальной контаминации воздуха»).
1.2.
Пассивный метод контроля микробной контаминации
воздуха
Метод
заключается в экспозиции плотной питательной среды в открытых чашках Петри.
Частицы, присутствующие
в воздухе, со временем осаждаются на поверхность агара. Время экспозиции
составляет от 15
мин до нескольких часов. Однако длительная экспозиция
приводит к высыханию поверхности питательной среды и к ухудшению условий
сохранения и культивирования бактерий.
Этот метод
широко распространен и его применение целесообразно в сочетании с активным
методом контроля микробной контаминации воздуха.
Открытые
чашки Петри располагают в нескольких точках. Например, при розливе препаратов -
как можно ближе к наполняющим иглам и в точки «наихудших условий». В
асептических зонах класса А (100) и В (100) при экспозиции чашек Петри с
питательной средой в течение 30 мин во время работы допускается рост одной,
редко двух колоний.
|
Преимущества
|
Ограничения
|
|
Простота использования
|
Отбор только быстро оседающих больших частиц
|
|
Не требует процесса посева
|
Влияние температуры на эффективность сбора
|
|
Различные типы питательной среды могут быть использованы для проращивания
плесени, грибов, всего спектра микроорганизмов или отдельного вида
|
Сильное влияние скорости и направления воздушного потока
по отношению к поверхности среды на результаты теста
|
|
Очень экономичен
|
Неопределенность объема отобранной пробы
|
2. Методы отбора
проб с поверхностей
Для контроля
микробной контаминации рабочих поверхностей используются следующие методы:
- смыв;
- контактная
пластина.
Репрезентативной
считается проба, снятая с поверхности площадью от 24 до 30 см2.
Если накопленные
результаты текущего мониторинга свидетельствуют о постоянном присутствии
определенной группы микроорганизмов, то для их идентификации может быть
использован соответствующий тип питательной среды.
Смывы с
поверхностей проводят стерильным ватным тампоном, укрепленном на стеклянном или
металлическом держателе, вмонтированном в ватно-марлевую пробку пробирки. В
пробирке должно содержаться приблизительно 2 мл стерильной воды для инъекций.
В чашки Петри
разливают по 20-25 мл питательной среды № 1 для бактерий и среды № 2 для грибов и дрожжей (по ГФ изд. XI, вып. 2). Перед
исследованиями чашки с разлитой средой выдерживают в термостате в течение 1
суток при температуре от 30 до 35 °С. Проросшие чашки не
используют.
Смывы проводят увлажненным тампоном с поверхности площадью от 24
до 30 см2.
После взятия
пробы провести несколько раз по поверхности питательной среды в двух
параллельных чашках Петри со средой № 1 и № 2. После отбора проб чашки Петри
помещают в термостат для инкубации для среды № 1 при температуре от 30 до 35 °С
в течение 48 ч, для среды № 2 - от 20 до 25 °С
в течение 72 ч. После истечения срока инкубации проводят подсчет колоний на
двух параллельных чашках, делают мазки, фиксируют их и окрашивают по Граму, микроскопируют.
На результаты
тестирования могут повлиять следующие факторы:
- угол снятия
пробы и давление тампона;
- присутствие
остатков дезинфектантов на поверхностях;
- возможность
повторного снятия мазка с того же участка поверхности.
Контактные
пластины готовятся с соответствующей плотной питательной средой, разливая
её на специальные пластины или таким образом, чтобы поверхность агара выступала
над краем чашки Петри.
При исследовании
снимают крышку с чашки и стерильная поверхность питательной среды накладывается
на гладкую ровную поверхность. После снятия отпечатка эту поверхность
необходимо обработать спиртом или любым другим дезинфектантом для удаления
остатков питательной среды. После инкубации в соответствии со сроками и
температурой для используемых сред (например, среды № 1
и № 2) проводят подсчет колоний и микроскопируют окрашенные по Граму мазки.
Метод контактных
пластин подходит для тестирования гладких и ровных поверхностей, таких, как
рабочий стол, стены, пол или одежда персонала.
3. Методы определения
микробной контаминации одежды и перчаток персонала
3.1.
Для определения микробной контаминации перчаток персонала используют следующий
метод:
Отпечатки пяти
пальцев каждой руки делают на поверхность плотной питательной среды, например, среды
№ 1 и среды № 2 (параллельно). Чтобы касание было полным, рекомендуется сделать
скользящее движение пальцами по всей поверхности агара. Руки после контакта с
агаром тщательно обрабатывают спиртом.
Рекомендуется
следующая частота тестирования: не менее одного раза в рабочую смену для АПЗ,
для других - от одного раза в неделю до одного раза в месяц,
в зависимости от степени автоматизации технологического процесса.
3.2. Микробная
контаминация одежды персонала обычно определяется на предплечьях с помощью контактных
пластин. Также проверяются бахилы.
Можно применять метод
смыва тампоном. Для этого делают смывы увлажненным тампоном с 4 участков
площадью по 25 см2 каждый на нижней части двух рукавов, верхней передней поверхности
комбинезона (халата) и шлеме.
После
тестирования одежда не должна более использоваться в АПЗ.
В данном
приложении описан аэрозольный пробоотборник «Флора-100»,
имеющий российский сертификат соответствия РОСС RU ИМ04.Н.00128 № 02549128, выданный органом по сертификации АНО «Центр ЦСМИ ВНИИ Медприбор». Пробоотборник рекомендуется для работы во всех классах чистоты А, В
(100), С (10000) и D (100000). Возможно применение любого подобного
пробоотборника отечественного и зарубежного производства, имеющего сертификат
соответствия и удовлетворяющего по диапазону пробоотбора
требованиям, предъявляемым уровню допустимой контаминации к классам чистоты А,
В (100), С (10000) и D (100000).
1. Область
применения и ограничения по использованию пробоотборника «Флора-100»
1.1.
Область применения
Определение
концентрации жизнеспособных микроорганизмов при проведении аттестации и
текущего контроля классов чистоты воздуха в чистых комнатах и чистых зонах.
1.2. Ограничения
по применению
Рекомендации не
распространяются на методы аттестации и контроля уровня вирусологического
загрязнения воздуха.
2. Устройство и
принцип работы пробоотборника «Флора-100»
Работа
пробоотборника основана на разгоне воздушного потока с помощью многосопловой
решетки до высокой линейной скорости и инерционном осаждении микроорганизмов на
плотную питательную среду, установленную перпендикулярно потоку.
3. Основные технические данные и характеристики
пробоотборника «Флора-100»
Пробоотборник
рассчитан на эксплуатацию при температуре от 0 до +50 °С
при относительной влажности воздуха - не более 80 %.
Объемная
скорость отбора пробы - 180 л/мин.
Режимы отбора
проб - 25, 100, 250 и 2000 л.
Диапазон
измеряемых концентраций микроорганизмов - 1-104 КОЕ
· м-3.
3.1.
Метрологическая поверка
Требования по
метрологической поверке должны указываться в паспортных данных на прибор.
4. Конструкция пробоотборника «Флора-100»
Пробоотборник
оформлен в виде переносного портативного прибора, состоящего из корпуса, в
котором смонтированы блок управления на печатных платах, аспиратор и
аккумуляторные батареи; и съемной ситовой решетки. Корпус и ситовая
решетка выполнены из анодированного алюминиевого сплава. Лицевая панель с
органами управления смонтирована на корпусе и
герметично закрыта гибкой пластиной. Прибор снабжен
съемным электрошнуром с блоком питания.
5. Меры безопасности
При подготовке
прибора к работе необходимо блок питания присоединить сначала к пробоотборнику,
а затем включить в сеть. Съем ситовой решетки и замену любого элемента
производить после отключения прибора и полной остановки двигателя аспиратора.
6. Подготовка пробоотборника «Флора-100» к работе
1. В стерильные
чашки Петри разлейте по 15±1 мл
питательной среды и оставьте для застывания на ровной горизонтальной
поверхности.
2. Снимите
защитную крышку сопловой решетки пробоотборника.
3. Поворотом
против часовой стрелки снимите верхнюю часть корпуса с сопловой решетки,
увлажните ватным тампоном, смоченным в этиловом спирте, и профламируйте
на пламени горелки до полного сгорания спирта. В случае повышенных требований к
стерильности операций пробоотбора съемную часть корпуса следует стерилизовать
либо в автоклаве при t = 121 °С в течение 1 ч, либо в
сухожаровом шкафу при t = 160 °С в течение 1,5 ч.
4. Установите
чашку с питательной средой в держатель пробоотборника, установите
верхнюю часть корпуса в исходное положение и зафиксируйте ее поворотом по
часовой стрелке.
5. Подключите
блок питания к импактору и вставьте его в сеть переменного тока 220 В, 50
Гц.
6. При питании
пробоотборника от встроенной аккумуляторной батареи (комплектуется по
требованию заказчика) блок питания подсоединять к пробоотборнику не следует.
7. Отбор пробы воздуха пробоотборником «Флора-100»
1.
Нажмите кнопку [СЕТЬ], расположенную на левой стенке пробоотборника, при этом
на передней панели пробоотборника загорится индикатор
«ВКЛ».
2. Нажмите
кнопку, имеющую маркировку требуемого объема отбираемого воздуха (25, 100, 250,
2000 л), при этом над кнопкой загорается красный световой индикатор и
появляется шум работающего аспиратора.
3. После отбора
заданного объема воздуха индикаторная лампа гаснет.
4. Порядок
работы пробоотборника от аккумуляторной батареи и сети переменного тока
одинаков.
5. Внимание! При работе пробоотборника
от аккумуляторной батареи необходимо не допускать ее разряда ниже 10 В. При
напряжении менее 10 В возникает мигание зеленой индикаторной лампы с
маркировкой «РАЗРЯД».
6. Для
повторного отбора пробы воздуха необходимо установить в импактор
новую чашку Петри с питательным агаром (см.
п.п. 6.2-6.6) и нажать кнопку требуемого объема.
7. По окончании отбора
нажмите кнопку [СЕТЬ], при этом питание прибора отключается, индикаторная лампа
«ВКЛ» гаснет.
8.
После отбора пробы снимите верхнюю часть корпуса пробоотборника с сопловой
решеткой, извлеките чашку Петри, закройте ее крышкой и поместите в термостат для
инкубации. После инкубации проведите подсчет колоний на поверхности питательной
среды.
8. Обработка результатов
1.
Для расчета концентрации микроорганизмов в воздухе определяют наиболее
вероятное число микробных частиц в пробе.
При количестве
колоний, не превышающем 35, наиболее вероятное число колониеобразующих
единиц равно числу колоний. Если количество более 35, наиболее вероятное число (Р) колониеобразующих единиц определяется по
формуле:
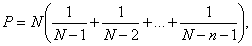 где
где
N - количество отверстий
в сопловой решетке (N = 367);
п - число колоний.
В таблице
представлены значения наиболее вероятного числа колониеобразующих единиц для
пробоотборника «Флора-100» (см. табл.).
2. Концентрация микроорганизмов
в пробе воздуха определяется путем деления числа колоний или наиболее
вероятного числа колониеобразующих единиц на объем отобранной пробы.
Таблица
|
n
|
p
|
n
|
p
|
n
|
p
|
n
|
p
|
n
|
p
|
n
|
p
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
1
|
1
|
32
|
33
|
63
|
69
|
94
|
108
|
125
|
153
|
156
|
203
|
|
2
|
2
|
32
|
35
|
64
|
70
|
95
|
110
|
126
|
154
|
157
|
205
|
|
3
|
3
|
34
|
36
|
65
|
71
|
96
|
111
|
127
|
156
|
158
|
206
|
|
4
|
4
|
35
|
37
|
66
|
73
|
97
|
112
|
128
|
157
|
159
|
208
|
|
5
|
5
|
36
|
38
|
67
|
74
|
98
|
114
|
129
|
159
|
160
|
210
|
|
6
|
6
|
37
|
39
|
68
|
75
|
99
|
115
|
130
|
160
|
161
|
212
|
|
7
|
7
|
38
|
40
|
69
|
76
|
100
|
117
|
131
|
162
|
162
|
213
|
|
8
|
8
|
39
|
41
|
70
|
78
|
101
|
118
|
132
|
163
|
163
|
215
|
|
9
|
9
|
40
|
42
|
71
|
79
|
102
|
119
|
133
|
165
|
164
|
217
|
|
10
|
10
|
41
|
43
|
72
|
80
|
103
|
121
|
134
|
166
|
165
|
219
|
|
11
|
11
|
42
|
45
|
73
|
81
|
104
|
122
|
135
|
168
|
166
|
221
|
|
12
|
12
|
43
|
46
|
74
|
83
|
105
|
123
|
136
|
170
|
167
|
222
|
|
13
|
13
|
44
|
47
|
75
|
84
|
106
|
125
|
137
|
171
|
168
|
224
|
|
14
|
14
|
45
|
48
|
76
|
85
|
107
|
126
|
138
|
173
|
169
|
226
|
|
15
|
15
|
46
|
49
|
77
|
86
|
108
|
128
|
139
|
174
|
170
|
228
|
|
16
|
16
|
47
|
50
|
78
|
88
|
109
|
129
|
140
|
176
|
171
|
230
|
|
17
|
17
|
48
|
51
|
79
|
89
|
110
|
131
|
141
|
178
|
172
|
232
|
|
18
|
18
|
49
|
53
|
80
|
90
|
111
|
132
|
142
|
179
|
173
|
234
|
|
19
|
19
|
50
|
54
|
81
|
91
|
112
|
133
|
143
|
181
|
174
|
235
|
|
20
|
21
|
51
|
55
|
82
|
93
|
113
|
135
|
144
|
183
|
175
|
237
|
|
21
|
22
|
52
|
56
|
83
|
94
|
114
|
136
|
145
|
184
|
176
|
239
|
|
22
|
23
|
53
|
57
|
84
|
95
|
115
|
138
|
146
|
186
|
177
|
241
|
|
23
|
24
|
54
|
58
|
85
|
97
|
116
|
139
|
147
|
187
|
178
|
243
|
|
24
|
25
|
55
|
59
|
86
|
98
|
117
|
141
|
148
|
189
|
179
|
245
|
|
25
|
26
|
56
|
60
|
87
|
99
|
118
|
142
|
149
|
191
|
180
|
247
|
|
26
|
27
|
57
|
62
|
88
|
100
|
119
|
143
|
150
|
193
|
181
|
249
|
|
27
|
28
|
58
|
63
|
89
|
102
|
120
|
145
|
151
|
194
|
182
|
251
|
|
28
|
29
|
59
|
64
|
90
|
103
|
121
|
147
|
152
|
196
|
183
|
253
|
|
29
|
30
|
60
|
65
|
91
|
104
|
122
|
148
|
153
|
198
|
184
|
255
|
|
30
|
31
|
61
|
67
|
92
|
106
|
123
|
150
|
154
|
199
|
185
|
257
|
|
31
|
32
|
62
|
68
|
93
|
107
|
124
|
151
|
155
|
201
|
186
|
259
|
|
187
|
259
|
217
|
325
|
247
|
406
|
277
|
510
|
307
|
656
|
337
|
902
|
|
183
|
161
|
218
|
328
|
248
|
409
|
278
|
514
|
308
|
662
|
338
|
913
|
|
189
|
263
|
219
|
330
|
249
|
412
|
279
|
518
|
309
|
668
|
339
|
926
|
|
190
|
265
|
220
|
333
|
250
|
415
|
280
|
523
|
310
|
674
|
340
|
938
|
|
191
|
267
|
221
|
335
|
251
|
417
|
281
|
527
|
311
|
681
|
341
|
951
|
|
192
|
269
|
222
|
338
|
252
|
422
|
282
|
531
|
312
|
687
|
342
|
965
|
|
193
|
271
|
223
|
340
|
253
|
425
|
283
|
535
|
313
|
694
|
343
|
979
|
|
194
|
273
|
224
|
343
|
254
|
428
|
284
|
539
|
314
|
700
|
344
|
994
|
|
195
|
275
|
225
|
345
|
255
|
431
|
285
|
544
|
315
|
707
|
345
|
1009
|
|
196
|
278
|
226
|
348
|
256
|
434
|
286
|
548
|
316
|
714
|
346
|
1025
|
|
197
|
280
|
227
|
350
|
257
|
438
|
287
|
553
|
317
|
721
|
347
|
1042
|
|
198
|
282
|
228
|
353
|
258
|
441
|
288
|
557
|
318
|
728
|
348
|
1059
|
|
199
|
284
|
229
|
355
|
259
|
444
|
289
|
562
|
319
|
736
|
349
|
1078
|
|
200
|
286
|
230
|
358
|
260
|
448
|
290
|
567
|
320
|
743
|
350
|
1097
|
|
201
|
288
|
231
|
361
|
261
|
451
|
291
|
571
|
321
|
751
|
351
|
1117
|
|
202
|
291
|
232
|
363
|
262
|
455
|
292
|
576
|
322
|
759
|
352
|
1139
|
|
203
|
293
|
233
|
366
|
263
|
458
|
293
|
581
|
323
|
767
|
353
|
1162
|
|
204
|
295
|
234
|
369
|
264
|
462
|
294
|
586
|
324
|
775
|
354
|
1186
|
|
205
|
297
|
235
|
372
|
265
|
465
|
295
|
591
|
325
|
783
|
355
|
1212
|
|
206
|
299
|
236
|
374
|
266
|
469
|
296
|
596
|
326
|
792
|
356
|
1241
|
|
207
|
302
|
237
|
377
|
267
|
472
|
297
|
601
|
327
|
800
|
357
|
1271
|
|
208
|
304
|
238
|
380
|
268
|
476
|
298
|
606
|
328
|
809
|
358
|
1305
|
|
209
|
306
|
239
|
383
|
269
|
480
|
299
|
611
|
329
|
819
|
359
|
1341
|
|
210
|
309
|
240
|
386
|
270
|
483
|
300
|
617
|
330
|
828
|
360
|
1382
|
|
211
|
311
|
241
|
389
|
271
|
487
|
301
|
622
|
331
|
838
|
361
|
1428
|
|
212
|
313
|
242
|
391
|
272
|
491
|
302
|
627
|
332
|
848
|
362
|
1480
|
|
213
|
316
|
243
|
394
|
273
|
495
|
303
|
633
|
333
|
858
|
363
|
1542
|
|
214
|
318
|
244
|
397
|
274
|
498
|
304
|
639
|
334
|
868
|
364
|
1615
|
|
215
|
320
|
245
|
400
|
275
|
502
|
305
|
644
|
335
|
879
|
365
|
1707
|
|
216
|
323
|
246
|
403
|
276
|
506
|
306
|
650
|
336
|
890
|
366
|
1829
|
|
|
|
|
|
|
|
|
|
|
|
367*
|
|
* при количестве колоний 367 и
более проба считается недействительной.
1.
Производство и контроль медицинских иммунобиологических препаратов для
обеспечения их качества: Санитарные правила СП
3.3.2.015-94. - М.:
Информационно-издательский центр Госкомсанэпиднадзора России, 1994.
2. Асептическое
производство медицинских иммунобиологических препаратов: Методические
рекомендации МУ 44-116. - М., 1997.
3. Организация и
контроль производства лекарственных средств. Стерильные лекарственные средства:
Методические указания МУ 42-51-1-93 -
МУ 42-51-26-93. - М., 1993.
4.
Государственная Фармакопея СССР XI издание, вып.
2, 1989.
5. Technical Monograph № 2, «Validation of Aseptic
Filling for Solution Drug Products», 1992.
6. Center for Devices and Radiological Health «Medical
Devices Quality Systems
Manual», p. 6 «Buildings and Environment», 1997.
7. Fundamentals of a Microbiological Environmental
Monitoring Program. Technical Report № 13, PDA, 1990.
8. Revisions of the Annex 1 to EU Guide to Good
Manufacturing Practice, Brussels, 1996.
Новости
Библиотека
Soft по ОТ и ПБ
Консультации
Агрегатор
Услуги
Форум
Золотой фонд
ССОТ
CHAT-OT


.webp)

